
Cytrynian sodu (C6H5O7Na3) Struktura, zastosowanie, właściwości
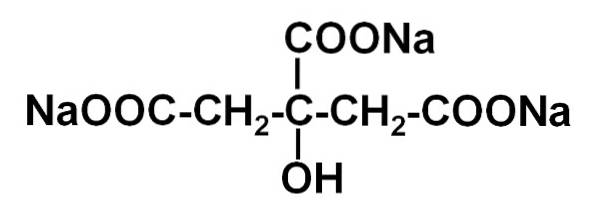
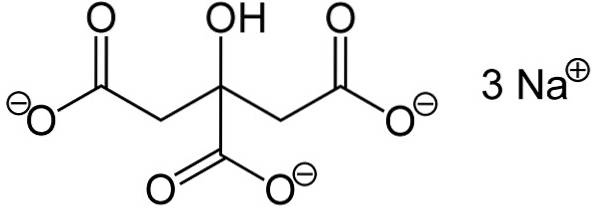
Plik cytrynianu sodowego Jest to sól sodowa kwasu cytrynowego. Tworzy ją anion cytrynianowy C.6H.5LUB73- i trzy kationy sodowe sodu+. Jego wzór cząsteczkowy to C.6H.5LUB7Na3 lub w rozszerzonej formie: NaOOC-CHdwa-C (COONa) (OH) -CHdwa-COONa. Cytrynian sodu jest sprzężoną zasadą kwasu cytrynowego, to znaczy teoretycznie jest otrzymywany z tego ostatniego przez podstawienie każdego protonu H+ -COOH dla sodu Na+.
Można go przygotować w postaci bezwodnej (bez wody w swoim składzie) lub w postaci uwodnionej z 2 lub 5 cząsteczkami wody. Jest to związek, który w stanie bezwodnym (bez wody) ma tendencję do wchłaniania wody ze środowiska.
Cytrynian sodu działa jako bufor, czyli stabilizuje pH, które jest miarą kwasowości lub zasadowości roztworu wodnego. Ma również właściwość tworzenia trwałego związku z jonami wapnia Ca.dwa+, cytrynian wapnia.
Jest stosowany na przykład w przemyśle spożywczym, aby zapobiec tworzeniu się z mleka krowiego grudek trudnych do strawienia przez niemowlęta.
W laboratoriach wykonujących testy biologiczne jest stosowany w celu zapobiegania krzepnięciu krwi pobieranej od pacjentów do niektórych testów. Zapobiega również krzepnięciu krwi używanej do transfuzji. Jest szeroko stosowany w detergentach niezawierających fosforanów, ponieważ nie powoduje zanieczyszczeń.
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Rozpuszczalność
- 3,5 pH
- 3.6 Właściwości chemiczne
- 3.7 Inne właściwości
- 4 Otrzymywanie
- 4.1 Lokalizacja w przyrodzie
- 5 zastosowań
- 5.1 W przemyśle spożywczym
- 5.2 W medycynie
- 5.3 W przemyśle farmaceutycznym
- 5.4 W badaniach krwi
- 5.5 W syntezie nanocząstek
- 5.6 W detergentach przyjaznych dla środowiska
- 5.7 Poprawa eksploatacji piasków roponośnych
- 5.8 W innych aplikacjach
- 6 Odnośniki
Struktura
Cytrynian trójsodowy składa się z trzech jonów sodowych Na+ i jon cytrynianowy.
Jon cytrynianowy składa się z łańcucha trzech atomów węgla, do którego przyłączone są 3 karboksylany -COO- (jeden na każdy atom węgla) i hydroksylo-OH przy centralnym atomie węgla.
Każdy z 3 jonów Na+ jest przyłączony do grupy -COO-.
Nomenklatura
- Cytrynianu sodowego
- Cytrynian trisodowy
- 2-hydroksypropano-1,2,3-trikarboksylan trisodu
Nieruchomości
Stan fizyczny
Białe lub bezbarwne krystaliczne ciało stałe.
Waga molekularna
258,07 g / mol
Temperatura topnienia
300 ºC
Rozpuszczalność
Bardzo dobrze rozpuszcza się w wodzie: 42,5 g / 100 ml w temperaturze 25 ºC. Jest praktycznie nierozpuszczalny w alkoholu.
pH
5% wodny roztwór cytrynianu sodu ma pH między 7,5 a 9,0, to znaczy jest lekko zasadowy.
Właściwości chemiczne
Cytrynian sodu jest buforem, co oznacza, że stabilizuje pH, które jest miarą kwasowości lub zasadowości roztworu wodnego. Cytrynian stabilizując pH nie pozwala na zakwaszenie lub alkalizację roztworu powyżej pewnych wartości.
Gdy występuje nadmiar protonów H.+ zabiera je do konwersji ich grup -COO- w grupach -COOH. I odwrotnie, jeśli jest wiele grup OH- oddaje protony ich grup -COOH i przekształca je w -COO-.
Kiedy jest przekształcany przez organizm, dostarcza 3 cząsteczki HCO3- dla każdej cząsteczki cytrynianu.
Inne właściwości
Jego kryształy rozpływają się, to znaczy pochłaniają wodę z powietrza. Dihydrat cytrynianu sodu jest bardziej stabilny w powietrzu.
Po podgrzaniu dwuwodzianu po osiągnięciu temperatury 150 ° C staje się on bezwodny (bez wody).
Podobnie jak kwas cytrynowy cytrynian sodu ma kwaśny smak.
Otrzymywanie
Cytrynian sodu jest zwykle wytwarzany przez dodanie węglanu sodu do roztworu kwasu cytrynowego, aż do ustania musowania. Musowanie jest spowodowane wydzielaniem się dwutlenku węgla COdwa:
NadwaWSPÓŁ3 + Kwas cytrynowy → Cytrynian sodu + COdwa↑
Następnie z roztworu odparowuje się wodę w celu wykrystalizowania produktu.
Można go również przygotować, traktując roztwór siarczanu sodu cytrynianem wapnia:
Nadwapołudniowy zachód4 + Cytrynian wapnia → Cytrynian sodu + CaSO4↓
Roztwór jest filtrowany w celu usunięcia CaSO4 ciało stałe, które się wytrąciło. Następnie roztwór jest zatężany i w ten sposób cytrynian sodu krystalizuje.
Lokalizacja w przyrodzie
Cytrynian sodu to koniugat na bazie kwasu cytrynowego, który jest naturalnym związkiem występującym we wszystkich organizmach żywych, ponieważ jest częścią ich metabolizmu, czyli mechanizmu wytwarzania energii w komórkach..
Aplikacje
W przemyśle spożywczym
Cytrynian sodu ma różne zastosowania w przemyśle spożywczym, na przykład jako regulator kwasowości, sekwestrant, stabilizator, środek powierzchniowo czynny lub emulgator..
Znajduje zastosowanie m.in. w napojach, mrożonych deserach i specjalnych serach.
Pozwala uniknąć koagulacji mleka, dlatego dodaje się go do mleka krowiego używanego do karmienia dzieci w okresie laktacji. W ten sposób żołądek dzieci nie tworzy trudnych do strawienia skrzepów lub twardego twarogu..

Służy do przyspieszania utrwalania koloru w peklowanej wieprzowinie lub wołowinie, czyli mięsie poddanym obróbce zapobiegającej zepsuciu. Zastąpiono w nich do 50% kwasu askorbinowego.

Jest również stosowany w celu zapobiegania krzepnięciu krwi świeżej wołowiny (np. Steków).
W medycynie
Stosowany jest jako środek alkalizujący, ponieważ neutralizuje nadmiar kwasu we krwi i moczu. Jest wskazany w leczeniu kwasicy metabolicznej, która występuje, gdy organizm wytwarza zbyt dużo kwasu.
Po spożyciu jon cytrynianowy staje się jonem wodorowęglanowym, który jest ogólnoustrojowym środkiem alkalizującym (czyli całego organizmu), w wyniku czego jony H są neutralizowane.+, zwiększa pH krwi i odwraca lub eliminuje kwasicę.
Cytrynian sodu służy jako środek neutralizujący przy rozstroju żołądka.
Jest stosowany jako środek wykrztuśny i potowy. Ma działanie moczopędne. Zwiększa wydalanie wapnia z moczem, dlatego jest stosowany w hiperkalcemii, czyli wtedy, gdy we krwi występuje nadmiar wapnia.
Służy również do ułatwienia usuwania ołowiu w przypadku zatrucia ołowiem..
Podany w nadmiarze może powodować zasadowicę, skurcze mięśni spowodowane nieprawidłowym działaniem przytarczyc i zahamowanie czynności serca, między innymi na skutek obniżenia poziomu wapnia we krwi..
Cytrynian sodu jest używany do transfuzji. Jest dodawany do krwi razem z dekstrozą, aby zapobiec jej krzepnięciu.
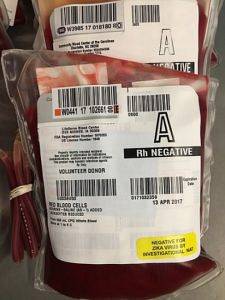
Normalnie wątroba szybko metabolizuje cytrynian uzyskany podczas transfuzji, jednak podczas transfuzji dużych ilości może dojść do przekroczenia pojemności wątroby..
W takich przypadkach, ponieważ cytrynian tworzy kompleks z wapniem, następuje zmniejszenie ilości jonów wapnia Ca.dwa+ w krwi. Może to prowadzić do zawrotów głowy, drżenia, mrowienia itp. Dlatego transfuzje należy wykonywać powoli.
W przemyśle farmaceutycznym
Wśród wielu innych zastosowań służy do zapobiegania ciemnieniu narkotyków, w których występuje żelazo i garbniki.
W badaniach krwi
Jest stosowany jako antykoagulant przy pobieraniu krwi lub gdy musi być przechowywany, ponieważ działa jako chelator jonów wapnia Cadwa+, to znaczy wiąże się z jonami wapnia, tworząc niezjonizowany cytrynian wapnia.
Znajduje zastosowanie w testach krzepnięcia oraz do określania szybkości sedymentacji krwinek czerwonych..
Jest stosowany jako antykoagulant podczas plazmaferezy, zabiegu usuwania z krwi nadmiaru substancji szkodliwych dla organizmu..
W syntezie nanocząstek
Stosowany jest jako stabilizator w syntezie nanocząstek złota. Dihydrat cytrynianu trisodu dodaje się do kwasu chloroaurynowego, tworząc zawiesinę o barwie czerwonego wina..
Cytrynian sodu służy jako środek redukujący i przeciwpłytkowy, ponieważ adsorbuje się na nanocząstkach..
Dzięki ujemnemu ładunkowi cytrynianu cząsteczki odpychają się nawzajem, unikając aglomeracji i tworząc stabilną dyspersję. Im wyższe stężenie cytrynianu, tym mniejsze cząstki..
Te nanocząsteczki są wykorzystywane do przygotowania bioczujników medycznych.
W detergentach przyjaznych dla środowiska
Cytrynian sodu jest szeroko stosowany w płynnych detergentach niezawierających fosforanów. Dzieje się tak, ponieważ jego zachowanie w środowisku jest nieszkodliwe, ponieważ jest metabolitem występującym we wszystkich żywych organizmach..
Jest łatwo biodegradowalny i słabo toksyczny dla organizmów wodnych. Z tego powodu jest uważany za środek czyszczący o właściwościach korzystnych dla środowiska..
W usprawnieniu eksploatacji piasków roponośnych
Piaski roponośne to piaszczyste utwory bogate w bitum lub smołę, materiał podobny do ropy naftowej.
Cytrynian sodu został pomyślnie przetestowany w połączeniu z wodorotlenkiem sodu NaOH w celu ekstrakcji oleju z piasków bitumicznych.
Uważa się, że połączenie cytrynianu z piaskowcem powoduje powstanie jonów -COO- Cytrynian tworzy dużą liczbę ładunków ujemnych na cząstkach krzemionki. Zapewnia to lepsze oddzielenie piasku od bitumu poprzez proste odpychanie ujemnych ładunków żwiru od ujemnych ładunków bitumu..
W innych aplikacjach
Znajduje zastosowanie w fotografii, do usuwania metali śladowych, w galwanotechnice i do usuwania SOdwa gazy odlotowe.
Bibliografia
- NAS. National Library of Medicine. (2019). Cytrynianu sodowego. Odzyskany z: pubchem.ncbi.nlm.nih.gov.
- McNamara, C. (2017). Pobieranie i postępowanie z krwią. In Dacie and Lewis Practical Hematology (wydanie dwunaste). Odzyskany z sciencedirect.com.
- Steber, J. (2007). Ekotoksyczność składników środków czyszczących. W Podręczniku czyszczenia / odkażania powierzchni. Odzyskany z sciencedirect.com.
- Xiang, B. i in. (2019). Badanie roli cytrynianu sodu w uwalnianiu asfaltu. Paliwa energetyczne 2019, 33, 8271-8278. Odzyskany z pubs.acs.org.
- Heddle, N. i Webert, K.E. (2007). Medycyna transfuzji. In Blood Banking and Transfusion Medicine (wydanie drugie). Odzyskany z sciencedirect.com.
- Sudhakar, S. i Santhosh, P.B. (2017). Nanomateriały złota. Postępy w biomembranach i samoorganizacji lipidów. Odzyskany z sciencedirect.com.
- Elsevier (od redakcji) (2018). Rozdział 8. Nanometal. W podstawach i zastosowaniach nanokrzemu w plazmonice i Fullerines. Aktualne i przyszłe trendy w mikro i nanotechnologiach. Strony 169-203. Odzyskany z sciencedirect.com.



Jeszcze bez komentarzy