
Wyrażenie stężenia chemicznego, jednostki, molalność

Plik stężenie chemiczne jest liczbową miarą względnej ilości substancji rozpuszczonej w roztworze. Miara ta wyraża stosunek substancji rozpuszczonej do ilości lub objętości rozpuszczalnika lub roztworu w jednostkach stężenia. Termin „stężenie” jest związany z ilością obecnej substancji rozpuszczonej: roztwór będzie tym bardziej stężony, im więcej będzie miał substancji rozpuszczonej.
Jednostki te mogą być fizyczne, gdy bierze się pod uwagę masę i / lub objętości roztworu lub składników chemicznych, gdy stężenie substancji rozpuszczonej jest wyrażane w liczbie moli lub równoważników, biorąc za odniesienie liczbę Avogadro..

Tak więc, wykorzystując masy cząsteczkowe lub atomowe oraz liczbę Avogadro, można przekształcić jednostki fizyczne w jednostki chemiczne przy wyrażaniu stężenia danej substancji rozpuszczonej. Dlatego wszystkie jednostki można przekonwertować na to samo rozwiązanie.
Indeks artykułów
- 1 Rozcieńczone i stężone roztwory
- 2 sposoby wyrażania koncentracji
- 2.1 Opis jakościowy
- 2.2 Klasyfikacja według rozpuszczalności
- 2.3 Oznaczenie ilościowe
- 3 jednostki stężenia
- 3.1 Względne jednostki stężenia
- 3.2 Jednostki rozcieńczonego stężenia
- 3.3 Jednostki stężenia jako funkcja moli
- 3.4 Formalność i normalność
- 4 Molarność
- 4.1 Ćwiczenie 1
- 4.2 Ćwiczenie 2
- 5 Normalność
- 5.1 Obliczenia
- 5.2 Ćwiczenie 1
- 6 Molalność
- 6.1 Ćwiczenie 1
- 7 Ważne uwagi i zalecenia dotyczące stężenia substancji chemicznych
- 7.1 Objętość roztworu jest zawsze większa niż rozpuszczalnika
- 7.2 Użyteczność molarności
- 7.3 Formuły nie są zapamiętywane, ale jednostki lub definicje
- 8 Odniesienia
Rozcieńczone i skoncentrowane roztwory
Jak możesz stwierdzić, czy stężenie jest bardzo rozcieńczone, czy skoncentrowane? Na pierwszy rzut oka przejawem jakichkolwiek właściwości organoleptycznych lub chemicznych; to znaczy te, które postrzegają zmysły lub które można zmierzyć.
Powyższy rysunek przedstawia rozcieńczenie stężenia dichromianu potasu (KdwaCrdwaLUB7), który ma kolor pomarańczowy. Od lewej do prawej widać, jak kolor zmniejsza swoją intensywność, gdy stężenie jest rozcieńczane, dodając więcej rozpuszczalnika.
To rozcieńczenie umożliwia uzyskanie w ten sposób rozcieńczonego stężenia ze stężonego. Kolor (i inne „ukryte” właściwości pomarańczowego rdzenia) zmienia się w taki sam sposób, jak zmienia się jego stężenie, za pomocą jednostek fizycznych lub chemicznych..
Ale jakie są chemiczne jednostki stężenia? Wśród nich są molarność lub stężenie molowe roztworu, które wiąże liczbę moli substancji rozpuszczonej z całkowitą objętością roztworu w litrach.
Istnieje również molalność lub też nazywane stężeniem molowym, które odnosi się do moli substancji rozpuszczonej, ale które są zawarte w znormalizowanej ilości rozpuszczalnika lub rozpuszczalnika, która wynosi dokładnie jeden kilogram.
Rozpuszczalnik ten może być czysty lub jeśli roztwór zawiera więcej niż jeden rozpuszczalnik, molalność będzie równa liczbie moli substancji rozpuszczonej na kilogram mieszaniny rozpuszczalników..
Trzecią jednostką stężenia chemicznego jest normalne lub normalne stężenie roztworu, które wyraża liczbę równoważników chemicznych substancji rozpuszczonej na litr roztworu.
Jednostka, w której wyrażana jest normalność, to ekwiwalenty na litr (Eq / l), aw medycynie stężenie elektrolitów w surowicy ludzkiej wyrażane jest w miliekwiwalentach na litr (mEq / l).
Sposoby wyrażania koncentracji

Stężenie roztworu można oznaczyć trzema głównymi sposobami, mimo że same w sobie mają dużą różnorodność terminów i jednostek, które można wykorzystać do wyrażenia miary tej wartości: opis jakościowy, notacja ilościowa i klasyfikacja pod względem rozpuszczalności.
W zależności od języka i kontekstu, w którym pracujesz, zostanie wybrany jeden z trzech sposobów wyrażenia stężenia mieszaniny.
Opis jakościowy
Użyty głównie językiem nieformalnym i nietechnicznym, jakościowy opis stężenia mieszaniny jest wyrażony w postaci przymiotników, które w sposób uogólniony wskazują na poziom stężenia, jaki ma roztwór.
W ten sposób minimalny poziom stężenia zgodnie z opisem jakościowym to „rozcieńczony” roztwór, a maksymalny to „stężony”..
O roztworach rozcieńczonych mówimy, gdy roztwór ma bardzo niski udział substancji rozpuszczonej w funkcji całkowitej objętości roztworu. Jeśli chcesz rozcieńczyć roztwór, musisz dodać więcej rozpuszczalnika lub znaleźć sposób na zmniejszenie ilości substancji rozpuszczonej.
Teraz mówimy o stężonych roztworach, gdy mają one wysoki udział substancji rozpuszczonej w funkcji całkowitej objętości roztworu. Aby zatężyć roztwór, należy dodać więcej substancji rozpuszczonej lub zmniejszyć ilość rozpuszczalnika.
W tym sensie klasyfikacja ta nazywana jest opisem jakościowym, nie tylko ze względu na brak pomiarów matematycznych, ale także ze względu na jej jakość empiryczną (można ją przypisać cechom wizualnym, zapachom i smakom, bez konieczności przeprowadzania badań naukowych)..
Klasyfikacja według rozpuszczalności
Rozpuszczalność stężenia oznacza maksymalną pojemność substancji rozpuszczonej, jaką ma roztwór, w zależności od warunków, takich jak temperatura, ciśnienie i substancje rozpuszczone lub w zawiesinie..
Roztwory można podzielić na trzy typy w zależności od poziomu rozpuszczonej substancji rozpuszczonej w czasie pomiaru: roztwory nienasycone, nasycone i przesycone.
- Roztwory nienasycone to takie, które zawierają mniej substancji rozpuszczonej niż roztwór może się rozpuścić. W tym przypadku roztwór nie osiągnął maksymalnego stężenia.
- Roztwory nasycone to takie, w których maksymalna możliwa ilość substancji rozpuszczonej rozpuściła się w rozpuszczalniku w określonej temperaturze. W takim przypadku istnieje równowaga między obiema substancjami, a roztwór nie może przyjąć większej ilości substancji rozpuszczonej (ponieważ będzie się wytrącać).
- Roztwory przesycone mają więcej substancji rozpuszczonych niż roztwór zaakceptowałby w warunkach równowagi. Osiąga się to przez ogrzewanie nasyconego roztworu, dodając więcej substancji rozpuszczonej niż normalnie. Po schłodzeniu nie wytrąca substancji rozpuszczonej automatycznie, ale wszelkie zakłócenia mogą spowodować ten efekt ze względu na jej niestabilność..
Notacja ilościowa
Podczas badania roztworu do zastosowania w dziedzinie technicznej lub naukowej wymagana jest precyzja mierzona i wyrażana w jednostkach, które opisują stężenie zgodnie z jego dokładnymi wartościami masy i / lub objętości..
Dlatego istnieje szereg jednostek używanych do wyrażenia stężenia roztworu w zapisie ilościowym, które są podzielone na fizyczne i chemiczne, a które z kolei mają własne podziały.
Jednostkami stężenia fizycznego są jednostki „stężenia względnego”, które są wyrażone w procentach. Istnieją trzy sposoby wyrażania stężeń procentowych: procenty masowe, procenty objętościowe i procenty masowo-objętościowe..
Zamiast tego jednostki stężeń substancji chemicznych są oparte na ilościach molowych, równoważnikach gramów, częściach na milion i innych właściwościach substancji rozpuszczonej w stosunku do roztworu..
Jednostki te są najczęściej spotykane ze względu na ich wysoką precyzję podczas pomiaru stężeń iz tego powodu są to najczęściej te, które chcesz znać podczas pracy z roztworami chemicznymi..
Jednostki stężenia
Jak opisano w poprzednich rozdziałach, przy ilościowym określaniu stężenia roztworu, obliczenia muszą być regulowane przez istniejące w tym celu jednostki..
Podobnie, jednostki stężenia są podzielone na jednostki o stężeniu względnym, o stężeniach rozcieńczonych, te oparte na moli i inne dodatkowe..
Względne jednostki stężenia
Względne stężenia to te wyrażone w procentach, jak podano w poprzedniej sekcji. Jednostki te są podzielone na procent masy i masy, procent objętości i objętości oraz procent masy i objętości i są obliczane w następujący sposób:
- % masy = masa substancji rozpuszczonej (g) / masa całkowitego roztworu (g) x 100
- % objętości = objętość substancji rozpuszczonej (ml) / objętość całkowitego roztworu (ml) x 100
- % masy / objętości = masa substancji rozpuszczonej (g) / objętość całkowitego roztworu (ml) x 100
W takim przypadku, aby obliczyć masę lub objętość całkowitego roztworu, masę lub objętość substancji rozpuszczonej należy dodać wraz z masą lub objętością rozpuszczalnika..
Jednostki rozcieńczonego stężenia
Jednostki rozcieńczonych stężeń to jednostki używane do wyrażania bardzo małych stężeń, które znajdują się w postaci śladów w rozcieńczonym roztworze; najczęstszym zastosowaniem tych jednostek jest znajdowanie śladów jednego gazu rozpuszczonego w innym, na przykład środków zanieczyszczających powietrze.
Jednostki te są podawane w postaci części na milion (ppm), części na miliard (ppb) i części na bilion (ppt) i są wyrażone w następujący sposób:
- ppm = 1 mg substancji rozpuszczonej / 1 l roztworu
- ppb = 1 μg substancji rozpuszczonej / 1 l roztworu
- ppt = 1 ng substancji rozpuszczonej / 1 l roztworu
W tych wyrażeniach mg to miligramy (0,001 g), μg to mikrogramy (0,000001 g), a ng to nanogramy (0,000000001 g). Jednostki te można również wyrazić jako funkcję objętości / objętości.
Jednostki stężenia jako funkcja moli
Jednostki stężenia oparte na molach to jednostki ułamka molowego, procent molowy, molarność i molowość (te dwie ostatnie są lepiej opisane na końcu artykułu).
Ułamek molowy substancji to ułamek wszystkich jej cząsteczek (lub atomów) składowych jako funkcja całkowitej liczby cząsteczek lub atomów. Oblicza się go w następujący sposób:
XDO = liczba moli substancji A / całkowita liczba moli w roztworze
Tę procedurę powtarza się dla innych substancji w roztworze, biorąc pod uwagę, że suma XDO + Xb + Xdo ... musi być równa jeden.
Procent moli jest przetwarzany w podobny sposób jak XDO, tylko w procentach:
Procent molowy A = XDO x 100%
W ostatniej sekcji szczegółowo omówimy molarność i molalność..
Formalność i normalność
Wreszcie istnieją dwie jednostki koncentracji, które są obecnie nieużywane: formalność i normalność..
Formalność rozwiązania przedstawia liczbę gramów receptury wagowej na litr całkowitego roztworu. Wyraża się jako:
F = nr P.F.G / L rozwiązanie
W tym wyrażeniu P.F.G jest równe masie każdego atomu substancji wyrażonej w gramach.
Zamiast tego normalność oznacza liczbę równoważników substancji rozpuszczonych podzieloną przez litry roztworu, jak podano poniżej:
N = równoważne gramy substancji rozpuszczonej / l roztworu
W tym wyrażeniu równoważne gramy substancji rozpuszczonej można obliczyć na podstawie liczby moli H.+, O- lub inne metody, w zależności od rodzaju cząsteczki.
Molarność
Molarność lub stężenie molowe substancji rozpuszczonej to jednostka stężenia chemicznego wyrażająca lub odnosząca liczbę moli substancji rozpuszczonej (n) zawartej w jednym (1) litrze (L) roztworu.
Molarność jest oznaczona wielką literą M i aby określić liczbę moli substancji rozpuszczonej (n), gramy substancji rozpuszczonej (g) dzieli się przez masę cząsteczkową (MW) substancji rozpuszczonej..
Podobnie masę cząsteczkową MW substancji rozpuszczonej otrzymuje się z sumy mas atomowych (PA) lub mas atomowych pierwiastków chemicznych, biorąc pod uwagę proporcję, w jakiej łączą się one tworząc substancję rozpuszczoną. Zatem różne substancje rozpuszczone mają własne PM (chociaż nie zawsze tak jest).
Te definicje są podsumowane w następujących wzorach, które są używane do wykonywania odpowiednich obliczeń:
Molarność: M = n (liczba moli substancji rozpuszczonej) / V (litr roztworu)
Liczba moli: n = g substancji rozpuszczonej / MW substancji rozpuszczonej
Ćwiczenie 1
Oblicz molarność roztworu przygotowanego z 45 g Ca (OH)dwa rozpuszczony w 250 ml wody.
Pierwszą rzeczą do obliczenia jest masa cząsteczkowa Ca (OH)dwa (wodorotlenek wapnia). Zgodnie ze swoim wzorem chemicznym, związek składa się z kationu wapnia i dwóch anionów hydroksylowych. Tutaj waga elektronu mniejszego lub dodatkowego w stosunku do gatunku jest pomijalna, więc przyjmuje się masy atomowe:
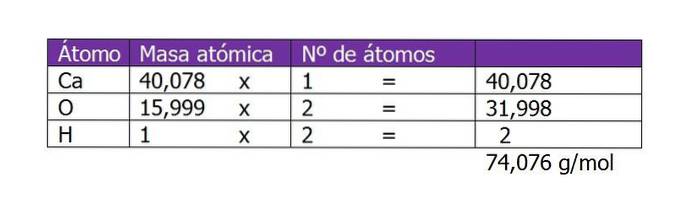
Liczba moli substancji rozpuszczonej będzie zatem wynosić:
n = 45 g / (74 g / mol)
n = 0,61 mola Ca (OH)dwa
Otrzymuje się 0,61 mola substancji rozpuszczonej, ale należy pamiętać, że te mole są rozpuszczone w 250 ml roztworu. Ponieważ definicja Molarności to mole w a litr lub 1000 ml, należy następnie przyjąć prostą regułę trzech, aby obliczyć liczbę moli znajdujących się w 1000 ml wspomnianego roztworu
Jeśli w 250 ml roztworu jest => 0,61 mola substancji rozpuszczonej
W 1000 ml roztworu => x Ile jest moli?
x = (0,61 mola) (1000 ml) / 250 ml
X = 2,44 M (mol / l)
Inny sposób
Innym sposobem uzyskania moli do zastosowania wzoru jest przeliczenie 250 ml na litry, również stosując regułę trzech:
Jeśli 1000 ml => to 1 litr
250 ml => x Ile to litrów?
x = (250 ml) (1 l) / 1000 ml
x = 0,25 l
Podstawiając następnie we wzorze Molarity:
M = (0,61 mola substancji rozpuszczonej) / (0,25 l roztworu)
M = 2,44 mol / l
Ćwiczenie 2
Co to znaczy, że roztwór HCl ma 2,5 M.?
Roztwór HCl ma 2,5 mola, czyli w jednym litrze rozpuszczono 2,5 mola kwasu solnego..
Normalna
Normalność lub stężenie równoważne to jednostka stężenia chemicznego roztworów oznaczona dużą literą N. Ta jednostka stężenia wskazuje reaktywność substancji rozpuszczonej i jest równa liczbie równoważników substancji rozpuszczonej (Eq) między objętością roztworu wyrażoną w litrach.
N = Eq / L
Liczba równoważników (Eq) jest równa liczbie gramów substancji rozpuszczonej podzielonej przez równoważnik masy (PEq).
Eq = g substancji rozpuszczonej / PEq
Ciężar równoważny, zwany również równoważnikiem gramowym, oblicza się, uzyskując masę cząsteczkową substancji rozpuszczonej i dzieląc ją przez równoważny współczynnik, który dla celów podsumowania w równaniu nazywa się delta zeta (ΔZ).
PEq = PM / ΔZ
Obliczenie
Obliczenie normalności będzie miało bardzo specyficzną zmienność współczynnika równoważnego lub ΔZ, która zależy również od rodzaju reakcji chemicznej, w której uczestniczy substancja rozpuszczona lub reaktywna. Niektóre przypadki tej odmiany można wymienić poniżej:
-Jeśli chodzi o kwas lub zasadę, ΔZ lub równoważny współczynnik będzie równy liczbie jonów wodoru (H+) lub hydroksyl OH- który ma substancję rozpuszczoną. Na przykład kwas siarkowy (H.dwapołudniowy zachód4) ma dwa odpowiedniki, ponieważ ma dwa kwasowe protony.
-Jeśli chodzi o reakcje utleniania-redukcji, ΔZ będzie odpowiadać liczbie elektronów zaangażowanych w proces utleniania lub redukcji, w zależności od konkretnego przypadku. Tutaj do gry wkraczają równoważenie równań chemicznych i specyfikacja reakcji..
-Podobnie ten równoważny współczynnik lub ΔZ będzie odpowiadał liczbie jonów, które wytrącają się w reakcjach sklasyfikowanych jako wytrącanie..
Ćwiczenie 1
Określ normalność 185 g Nadwapołudniowy zachód4 znaleziono w 1,3 l roztworu.
Masa cząsteczkowa substancji rozpuszczonej w tym roztworze zostanie obliczona jako pierwsza:
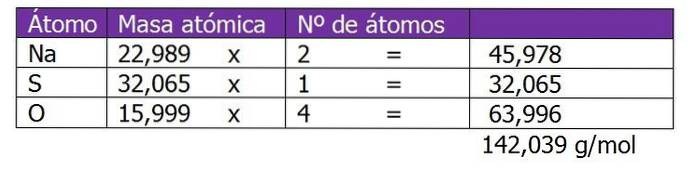
Drugim krokiem jest obliczenie współczynnika równoważnego lub ΔZ. W tym przypadku, ponieważ siarczan sodu jest solą, rozważa się wartościowość lub ładunek kationu lub Na metalu.+, który zostanie pomnożony przez 2, co jest indeksem dolnym wzoru chemicznego soli lub substancji rozpuszczonej:
Nadwapołudniowy zachód4 => ∆Z = Valencia Cation x Subscript
∆Z = 1 x 2
Aby uzyskać równoważną masę, należy ją podstawić w odpowiednim równaniu:
PEq = (142,039 g / mol) / (2 równoważniki / mol)
PEq = 71,02 g / równ
Następnie możesz przystąpić do obliczenia liczby odpowiedników, ponownie stosując inne proste obliczenia:
Równanie = (185 g) / (71,02 g / równ.)
Liczba ekwiwalentów = 2,605 równ
Wreszcie, mając wszystkie niezbędne dane, normalność jest teraz obliczana przez podstawienie zgodnie z jej definicją:
N = 2,605 Eq / 1,3 l
N = 2,0 N.
Molalność
Molalność jest oznaczona małą literą m y jest równe liczbie moli substancji rozpuszczonej obecnej w jednym (1) kilogramie rozpuszczalnika. Jest również znane jako stężenie molowe i jest obliczane przy użyciu następującego wzoru:
m = liczba moli substancji rozpuszczonej / kg rozpuszczalnika
Podczas gdy molarność określa stosunek moli substancji rozpuszczonej zawartej w jednym (1) litrze roztworu, molalność odnosi się do moli substancji rozpuszczonej występującej w jednym (1) kilogramie rozpuszczalnika.
W tych przypadkach, gdy roztwór jest przygotowywany z więcej niż jednego rozpuszczalnika, molalność będzie wyrażać te same mole substancji rozpuszczonej na kilogram mieszaniny rozpuszczalników..
Ćwiczenie 1
Określić molalność roztworu, który został przygotowany przez zmieszanie 150 g sacharozy (C.12H.220jedenaście) z 300 g wody.
Najpierw określa się masę cząsteczkową sacharozy, aby przejść do obliczenia moli substancji rozpuszczonej w tym roztworze:
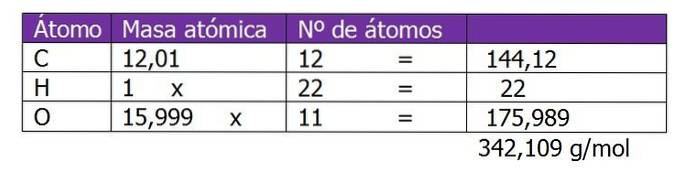
Oblicza się liczbę moli sacharozy:
n = (150 g sacharozy) / (342,109 g / mol)
n = 0,438 mola sacharozy
Następnie gramy rozpuszczalnika są przeliczane na kilogramy, aby można było zastosować ostateczną formułę.
Zastępując wtedy:
m = 0,438 mola sacharozy / 0,3 kg wody
m = 1,46 mola C12H.220jedenaście/ Kg H.dwaLUB
Chociaż obecnie toczy się debata na temat ostatecznego wyrażenia molalności, wynik ten można również wyrazić jako:
1,26 m C12H.220jedenaście lub 1,26 mol
Czasami uważa się za korzystne wyrażanie stężenia roztworu w kategoriach molowych, ponieważ masy substancji rozpuszczonej i rozpuszczalnika nie ulegają niewielkim fluktuacjom lub niewidocznym zmianom z powodu wpływu temperatury lub ciśnienia; jak to ma miejsce w roztworach z gazową substancją rozpuszczoną.
Ponadto zwraca się uwagę, że ta jednostka stężenia odnosząca się do określonej substancji rozpuszczonej pozostaje niezmieniona przez istnienie innych substancji rozpuszczonych w roztworze..
Zalecenia i ważne uwagi dotyczące stężenia substancji chemicznych
Objętość roztworu jest zawsze większa niż rozpuszczalnika
W miarę rozwiązywania zadań z roztworem pojawia się błąd interpretacji objętości roztworu tak, jakby była to objętość rozpuszczalnika. Na przykład, jeśli gram sproszkowanej czekolady zostanie rozpuszczony w litrze wody, objętość roztworu nie będzie równa litrowi wody..
Dlaczego nie? Ponieważ substancja rozpuszczona zawsze będzie zajmować przestrzeń między cząsteczkami rozpuszczalnika. Gdy rozpuszczalnik ma wysokie powinowactwo do substancji rozpuszczonej, zmiana objętości po rozpuszczeniu może być pomijalna lub nieistotna..
Ale jeśli nie, a tym bardziej, jeśli ilość substancji rozpuszczonej jest duża, należy wziąć pod uwagę zmianę objętości. Będąc w ten sposób: Vsolvent + Vsolute = Vsolution. Tylko w rozcieńczonych roztworach lub gdy ilość substancji rozpuszczonej jest mała, obowiązuje Vsolvent = Vsolution.
Należy pamiętać o tym błędzie, zwłaszcza podczas pracy z ciekłymi substancjami rozpuszczonymi. Na przykład, jeśli zamiast rozpuszczać sproszkowaną czekoladę, miód zostanie rozpuszczony w alkoholu, to ilość dodanego miodu będzie miała znaczący wpływ na całkowitą objętość roztworu..
Dlatego w takich przypadkach objętość substancji rozpuszczonej należy dodać do objętości rozpuszczalnika..
Użyteczność molarności
-Znajomość molarności stężonego roztworu pozwala na wykonanie obliczeń rozcieńczenia przy użyciu prostego wzoru M1V1 = M2V2, gdzie M1 odpowiada początkowej molarności roztworu, a M2 molarności roztworu przygotowanego z roztworu M1.
-Znając molarność roztworu, jego normalność można łatwo obliczyć za pomocą następującego wzoru: Normalność = liczba równoważników x M
Formuły nie są zapamiętywane, ale jednostki lub definicje są
Jednak czasami pamięć nie pamięta wszystkich równań związanych z obliczeniami stężenia. W tym celu bardzo przydatne jest posiadanie bardzo jasnej definicji każdego pojęcia.
Z definicji jednostki są zapisywane przy użyciu rozszerzenia przeliczniki aby wyrazić te, które odpowiadają temu, co chcesz określić.
Na przykład, jeśli masz molalność i chcesz przekonwertować ją na normalną, wykonaj następujące czynności:
(mol / kg rozpuszczalnika) x (kg / 1000 g) (g rozpuszczalnika / ml) (ml rozpuszczalnika / ml roztworu) (1000 ml / l) (Eq / mol)
Należy zauważyć, że (g rozpuszczalnika / ml) to gęstość rozpuszczalnika. Termin (ml rozpuszczalnika / ml roztworu) odnosi się do tego, ile objętości roztworu faktycznie odpowiada rozpuszczalnikowi. W wielu ćwiczeniach ten ostatni człon jest równy 1 ze względów praktycznych, chociaż nigdy nie jest to do końca prawdą..
Bibliografia
- Chemia wprowadzająca - 1św Wydanie kanadyjskie. Ilościowe jednostki stężenia. Rozdział 11 Rozwiązania. Zaczerpnięte z: opentextbc.ca
- Wikipedia. (2018). Równoważne stężenie. Zaczerpnięte z: en.wikipedia.org
- PharmaFactz. (2018). Co to jest molarność? Zaczerpnięte z: pharmafactz.com
- Whitten, Davis, Peck & Stanley. Chemia. (8th ed.). CENGAGE Learning, str 101-103, 512, 513.
- Roztwory wodne - molarność. Zaczerpnięte z: chem.ucla.edu
- Quimicas.net (2018). Przykłady normalności. Odzyskany z: quimicas.net.



Jeszcze bez komentarzy