
Właściwości, charakterystyka i zastosowania chromu

Plik chrom (Cr) jest metalicznym pierwiastkiem z grupy 6 (VIB) układu okresowego. Tony tego metalu są produkowane rocznie poprzez jego ekstrakcję z mineralnego chromitu żelaza lub magnezu (FeCrdwaLUB4, MgCrdwaLUB4), które są redukowane węglem w celu uzyskania metalu. Jest bardzo reaktywny i tylko w bardzo redukujących warunkach można go znaleźć w czystej postaci.
Jej nazwa wywodzi się od greckiego słowa „chroma”, które oznacza kolor. Nazwę tę nadano jej ze względu na liczne i intensywne kolory, jakie wykazują związki chromu, zarówno nieorganiczne, jak i organiczne; od czarnych ciał stałych lub roztworów do żółtego, pomarańczowego, zielonego, fioletowego, niebieskiego i czerwonego.

Jednak kolor metalicznego chromu i jego węglików jest srebrzystoszary. Ta cecha jest wykorzystywana w technice chromowania, aby nadać wielu strukturom srebrne iskierki (takie jak te widoczne na krokodylku na powyższym obrazku). W ten sposób, poprzez „kąpiel w chromie”, elementy zyskują połysk i dużą odporność na korozję..
Chrom w roztworze szybko reaguje z tlenem z powietrza, tworząc tlenki. W zależności od pH i warunków utleniania pożywki może przybierać różne stopnie utlenienia, będąc (III) (Cr3+) najbardziej stabilny ze wszystkich. W konsekwencji tlenek chromu (III) (CrdwaLUB3) kolor zielony jest najbardziej stabilnym z jego tlenków.
Tlenki te mogą wchodzić w interakcje z innymi metalami w środowisku, powodując np. Barwnik ołowiu syberyjskiego (PbCrO4). Pigment ten jest żółto-pomarańczowy lub czerwony (w zależności od jego zasadowości), z którego francuski naukowiec Louis Nicolas Vauquelin wyodrębnił metaliczną miedź, dlatego jest nagradzany jako odkrywca..
Jego minerały i tlenki, a także niewielka część metalicznej miedzi sprawiają, że pierwiastek ten zajmuje 22. miejsce wśród najbardziej rozpowszechnionych w skorupie ziemskiej..
Chemia chromu jest bardzo zróżnicowana, ponieważ może tworzyć wiązania z prawie całym układem okresowym. Każdy z jego związków wykazuje kolory, które zależą od stopnia utlenienia, a także gatunków, które z nim oddziałują. Podobnie tworzy wiązania z węglem, interweniując w wielu związkach metaloorganicznych..
[TOC]
Charakterystyka i właściwości
Chrom jest srebrzystym metalem w czystej postaci, o liczbie atomowej 24 i masie cząsteczkowej około 52 g / mol (52Cr, jego najbardziej stabilny izotop).
Dzięki silnym wiązaniom metalicznym ma wysoką temperaturę topnienia (1907 ºC) i wrzenia (2671 ºC). Ponadto jego krystaliczna struktura sprawia, że jest to bardzo gęsty metal (7,19 g / ml).
Nie reaguje z wodą tworząc wodorotlenki, ale reaguje z kwasami. Utlenia się z tlenem z powietrza, generalnie wytwarzając tlenek chromu, który jest szeroko stosowanym zielonym pigmentem..
Te warstwy tlenku tworzą coś, co jest znane jako pasywacja, ochrona metalu przed późniejszą korozją, ponieważ tlen nie może przedostać się do metalowej zatoki.
Jego konfiguracja elektronowa to [Ar] 4s13d5, ze wszystkimi elektronami niesparowanymi, a zatem wykazuje właściwości paramagnetyczne. Jednak parowanie spinów elektronicznych może wystąpić, jeśli metal zostanie poddany działaniu niskich temperatur, uzyskując inne właściwości, takie jak antyferromagnetyzm.
Indeks artykułów
- 1 Charakterystyka i właściwości
- 2 Struktura chemiczna chromu
- 3 stopień utlenienia
- 3,1 Cr (-2, -1 i 0)
- 3,2 Cr (I) i Cr (II)
- 3,3 Cr (III)
- 3,4 Cr (IV) i Cr (V)
- 3,5 Cr (VI): para chromian-dichromian
- 4 Zastosowania chromu
- 4.1 Jako barwnik lub pigmenty
- 4.2 W chromowaniu lub metalurgii
- 4.3 Odżywcze
- 5 Gdzie jest?
- 6 Odnośniki
Struktura chemiczna chromu
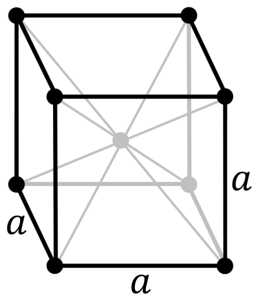
Jaka jest struktura chromowanego metalu? W czystej postaci chrom przyjmuje strukturę kryształu sześcienną (cc lub bcc) skoncentrowaną na ciele. Oznacza to, że atom chromu znajduje się w środku sześcianu, którego krawędzie zajmują inne chromy (jak na powyższym obrazku).
Struktura ta odpowiada za wysoką temperaturę topnienia i wrzenia chromu oraz dużą twardość. Atomy miedzi nakładają się na swoje orbitale s i d, tworząc pasma przewodnictwa zgodnie z teorią pasm.
Tak więc oba pasma są w połowie zapełnione. Dlaczego? Ponieważ jego konfiguracja elektronowa to [Ar] 4s13d5 i ponieważ orbital s może pomieścić dwa elektrony, a orbitale d - dziesięć. Wtedy tylko połowa pasm utworzonych przez ich zachodzenie na siebie jest zajęta przez elektrony..
Z tych dwóch perspektyw - struktury krystalicznej i wiązania metalicznego - wiele fizycznych właściwości tego metalu można wyjaśnić w teorii. Jednak żadne z nich nie wyjaśnia, dlaczego chrom może mieć różne stopnie lub liczby utlenienia..
Wymagałoby to dogłębnego zrozumienia stabilności atomu w odniesieniu do spinów elektronowych..
Numer utleniania
Ponieważ konfiguracja elektronowa chromu to [Ar] 4s13d5 może uzyskać do jednego lub dwóch elektronów (Cr1- i CRdwa-) lub zgub je, aby uzyskać różne stopnie utlenienia.
Tak więc, jeśli chrom straci elektron, pozostanie jako [Ar] 4s03d5; jeśli straci trzy, [Ar] 4s03d3; a jeśli straci je wszystkie, [Ar], lub to, co jest równe, byłoby izoelektroniczne dla argonu.
Chrom nie traci ani nie zyskuje elektronów przez zwykły kaprys: musi istnieć gatunek, który je przekazuje lub przyjmuje, aby przejść od jednego stopnia utlenienia do drugiego.
Chrom ma następujące stopnie utlenienia: -2, -1, 0, +1, +2, +3, +4, +5 i +6. Spośród nich +3, Cr3+, jest najbardziej stabilny, a zatem dominujący ze wszystkich; a następnie +6, Cr6+.
Cr (-2, -1 i 0)
Chrom jest mało prawdopodobny, aby pozyskać elektrony, ponieważ jest metalem, a zatem jego naturą jest ich dawanie. Jednak może koordynować się z ligandami, czyli cząsteczkami, które oddziałują z centrum metalu poprzez wiązanie celownicze..
Jednym z najbardziej znanych jest tlenek węgla (CO), który tworzy heksakarbonylowy związek chromu.
Ten związek ma wzór cząsteczkowy Cr (CO)6, a ponieważ ligandy są obojętne i nie zapewniają żadnego ładunku, to Cr ma stopień utlenienia równy 0.
Można to również zaobserwować w innych związkach metaloorganicznych, takich jak bis (benzen) chrom. W tym ostatnim chrom jest otoczony dwoma pierścieniami benzenowymi w strukturze molekularnej typu sandwich:
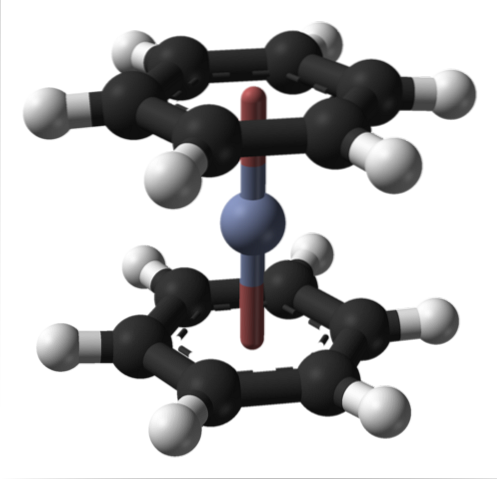
Z tych dwóch związków metaloorganicznych może powstać wiele innych z Cr (0).
Stwierdzono, że sole oddziałują z kationami sodu, co oznacza, że Cr musi mieć ujemny stopień utlenienia, aby przyciągać ładunki dodatnie: Cr (-2), Nadwa[Cr (CO)5] i Cr (-1), Nadwa[Crdwa(WSPÓŁ)10].
Cr (I) i Cr (II)
Cr (I) lub Cr1+ Jest wytwarzany przez utlenianie właśnie opisanych związków metaloorganicznych. Uzyskuje się to poprzez utlenianie ligandów, takich jak CN lub NO, tworząc w ten sposób np. Związek K.3[Cr (CN)5NIE].
Tutaj fakt posiadania trzech kationów K.+ Oznacza to, że kompleks chromu ma trzy ładunki ujemne; także ligand CN- wnosi pięć ładunków ujemnych, więc między Cr i NO musi dodać dwa ładunki dodatnie (-5 + 2 = -3).
Jeśli NO jest obojętne, to jest to Cr (II), ale jeśli ma ładunek dodatni (NO+), jest w tym przypadku Cr (I).
Z drugiej strony, związki Cr (II) są bardziej powszechne, w tym: chlorek chromu (II) (CrCldwa), octan chromu (Crdwa(LUBdwaCCH3)4), tlenek chromu (II) (CrO), siarczek chromu (II) (CrS) i inne.
Cr (III)
Ze wszystkich jest to ta o największej stabilności, ponieważ jest w rzeczywistości produktem wielu reakcji utleniania jonów chromianowych. Być może jego stabilność wynika z jego konfiguracji elektronicznej d3, w którym trzy elektrony zajmują trzy orbitale d o niższej energii w porównaniu do dwóch pozostałych orbitali bardziej energetycznych (rozszczepienie orbitali d).
Najbardziej reprezentatywnym związkiem tego stopnia utlenienia jest tlenek chromu (III) (CrdwaLUB3). W zależności od koordynujących z nią ligandów, kompleks będzie wykazywał taki czy inny kolor. Przykładami takich związków są: [CrCldwa(H.dwaLUB)4] Cl, Cr (OH)3, CrF3, [Cr (H.dwaLUB)6]3+, itp.
Chociaż wzór chemiczny nie pokazuje tego na pierwszy rzut oka, chrom zwykle zawiera w swoich kompleksach oktaedryczną sferę koordynacyjną; to znaczy, znajduje się w środku ośmiościanu, gdzie jego wierzchołki są ustawione przez ligandy (w sumie sześć).
Cr (IV) i Cr (V)
Związki, w których uczestniczy Cr5+ jest ich bardzo niewiele, ze względu na niestabilność elektronową wspomnianego atomu, oprócz tego, że łatwo utlenia się do Cr6+, znacznie bardziej stabilny, ponieważ jest izoelektroniczny w porównaniu do argonu z gazem szlachetnym.
Jednak związki Cr (V) można syntetyzować w określonych warunkach, takich jak wysokie ciśnienie. Podobnie mają tendencję do rozkładania się w umiarkowanych temperaturach, co uniemożliwia ich zastosowanie, ponieważ nie mają odporności termicznej. Niektóre z nich to: CrF5 i K.3[Cr (Odwa)4] (Odwadwa- jest anionem nadtlenkowym).
Z drugiej strony Cr4+ jest stosunkowo bardziej stabilny, będąc w stanie syntetyzować swoje związki chlorowcowane: CrF4, CrCl4 i CrBr4. Jednak są one również podatne na rozkład w reakcjach redoks w celu wytworzenia atomów chromu o lepszych stopniach utlenienia (takich jak +3 lub +6)..
Cr (VI): para chromian-dichromian
2 [CrO4]dwa- + 2H+ (Żółty) => [CrdwaLUB7]dwa- + H.dwaO (pomarańczowy)
Powyższe równanie odpowiada dimeryzacji kwasowej dwóch jonów chromianowych w celu wytworzenia dichromianu. Zmiana pH powoduje zmianę interakcji wokół metalowego środka Cr6+, również widoczne w kolorze roztworu (od żółtego do pomarańczowego lub odwrotnie). Dichromian składa się z mostka O.3Cr-O-CrO3.
Związki Cr (VI) mają właściwości szkodliwe, a nawet rakotwórcze dla organizmu ludzkiego i zwierząt.
W jaki sposób? Badania potwierdzają, że jony CrO4dwa- przecinają błony komórkowe pod działaniem białek transportujących siarczany (oba jony są w rzeczywistości podobnej wielkości).
Środki redukujące w komórkach redukują Cr (VI) do Cr (III), który gromadzi się poprzez nieodwracalną koordynację z określonymi miejscami na makrocząsteczkach (takich jak DNA).
Zanieczyszczona komórka nadmiarem chromu, nie może opuścić ze względu na brak mechanizmu transportującego ją z powrotem przez błony.
Chromium używa
Jako barwnik lub pigmenty
Chrom ma szeroki zakres zastosowań, od barwników do różnych rodzajów tkanin, po ochraniacze, które upiększają części metalowe w tak zwanym chromowaniu, które można wykonać z czystego metalu lub ze związków Cr (III) lub Cr (VI).
Fluorek chromu (CrF3) jest na przykład używany jako barwnik do tkanin wełnianych; siarczan chromu (Crdwa(POŁUDNIOWY ZACHÓD4)3) służy do barwienia emalii, ceramiki, farb, tuszy, lakierów, a także do chromowania metali; i tlenek chromu (CrdwaLUB3) znajduje również zastosowanie tam, gdzie wymagany jest atrakcyjny zielony kolor.
Dlatego każdy minerał chromu o intensywnych kolorach może być przeznaczony do zabarwienia struktury, ale potem powstaje fakt, czy te związki są niebezpieczne dla środowiska lub zdrowia ludzi..
W rzeczywistości jego trujące właściwości służą do ochrony drewna i innych powierzchni przed atakiem owadów..
W chromie lub metalurgii
Do stali dodaje się również niewielkie ilości chromu, aby wzmocnić ją przed utlenianiem i poprawić jej połysk. Dzieje się tak, ponieważ jest on zdolny do tworzenia szarawych węglików (Cr3dodwa) bardzo odporny na reagowanie z tlenem w powietrzu.
Ponieważ chrom można wypolerować, aby uzyskać błyszczące powierzchnie, chrom ma wówczas srebrne wzory i kolory jako tańszą alternatywę do tych celów..
Odżywcze
Niektórzy debatują, czy chrom można uznać za pierwiastek niezbędny, czyli niezbędny w codziennej diecie. Występuje w niektórych produktach spożywczych w bardzo małych stężeniach, takich jak zielone liście i pomidory..
Podobnie istnieją odżywki białkowe, które regulują aktywność insuliny i promują wzrost mięśni, tak jak w przypadku polinikotynianu chromu.
Gdzie to się znajduje?

Chrom występuje w wielu różnych minerałach i klejnotach, takich jak rubiny i szmaragdy. Głównym minerałem, z którego pozyskuje się chrom, jest chromit (MCrdwaLUB4), gdzie M może oznaczać dowolny inny metal, z którym związany jest tlenek chromu. Te kopalnie obfitują w RPA, Indiach, Turcji, Finlandii, Brazylii i innych krajach.
Każde źródło ma jedną lub więcej odmian chromitu. W ten sposób dla każdego M (Fe, Mg, Mn, Zn itp.) Powstaje inny minerał chromu.
Aby wydobyć metal, konieczne jest zredukowanie minerału, to znaczy, aby centrum metalicznego chromu zyskało elektrony przez działanie środka redukującego. Odbywa się to za pomocą węgla lub aluminium:
FeCrdwaLUB4 + 4C => Fe + 2Cr + 4CO
Ponadto chromit (PbCrO4).
Ogólnie w każdym minerale, w którym występuje jon Cr3+ może zastąpić Al3+, oba z nieco podobnymi promieniami jonowymi stanowią zanieczyszczenie, które daje kolejne naturalne źródło tego niesamowitego, ale szkodliwego metalu.
Bibliografia
- Tenenbaum E.. Chrom. Zaczerpnięte z: chemistry.pomona.edu
- Wikipedia. (2018). Chrom. Zaczerpnięte z: en.wikipedia.org
- Dr Anne Marie Helmenstine (6 kwietnia 2018). Jaka jest różnica między Chrome a Chromium? Zaczerpnięte z: thinkco.com
- N.V. Mandich. (1995). Chemia chromu. [PDF]. Zaczerpnięte z: citeseerx.ist.psu.edu
- Chemia LibreTexts. Chemia chromu. Zaczerpnięte z: chem.libretexts.org
- Saul 1. Shupack. (1991). Chemia chromu i niektóre wynikające z tego problemy analityczne. Sprawdzono z: ncbi.nlm.nih.gov
- Advameg, Inc. (2018). Chrom. Zaczerpnięte z: chemistryexplained.com



Jeszcze bez komentarzy