
Struktura dimetyloaminy ((CH3) 2NH), właściwości, zastosowania, zagrożenia

Plik dimetyloamina jest związkiem organicznym utworzonym przez dwie grupy metylowe -CH3 przyłączony do grupy -NH. Jego wzór chemiczny to (CH3)dwaNH. To bezbarwny gaz. Kiedy znajduje się w powietrzu przy niskich stężeniach, wyczuwalny jest rybi zapach. Natomiast jeśli jest w wysokim stężeniu to ma zapach amoniaku NH3.
Dimetyloamina występuje w roślinach i zwierzętach. Uważa się, że u ludzi powstaje w wyniku rozpadu niektórych enzymów, ale także w wyniku spożycia niektórych pokarmów, takich jak ryby. Jeśli gaz dimetyloamina rozpuszcza się w wodzie, tworzy silnie zasadowe i korodujące roztwory.
Ma różne zastosowania przemysłowe, takie jak produkcja rozpuszczalników, przyspieszanie wulkanizacji gumy, hamowanie korozji rur, wytwarzanie mydeł, przygotowywanie barwników i pochłanianie kwaśnych gazów w niektórych procesach..
Dimetyloamina to wysoce łatwopalny gaz. Pojemniki nie powinny być wystawiane na działanie ciepła lub ognia, ponieważ mogą wybuchnąć. Ponadto jego opary działają drażniąco na oczy, skórę i drogi oddechowe..
Jest to związek, który może być częścią aerozoli atmosferycznych, czyli bardzo drobnych kropelek znajdujących się w atmosferze.
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Temperatura wrzenia
- 3.5 Temperatura zapłonu
- 3.6 Temperatura samozapłonu
- 3.7 Gęstość
- 3.8 Rozpuszczalność
- 3,9 pH
- 3.10 Stała dysocjacji
- 3.11 Właściwości chemiczne
- 3.12 Inne właściwości
- 3.13 Reakcje biochemiczne
- 4 Otrzymywanie
- 5 Obecność w przyrodzie
- 5.1 Pacjenci z nadmiarem dimetyloaminy
- 6 zastosowań
- 7 Ryzyka
- 8 Wpływ DMA na atmosferę
- 9 Odniesienia
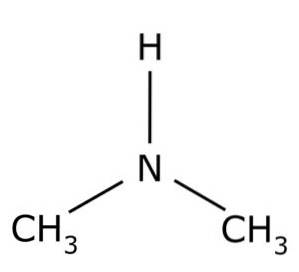
Struktura
Dimetyloamina jest drugorzędową aminą alifatyczną. Oznacza to, że podstawniki azotowe (N) są alifatyczne (-CH3), co oznacza, że nie są aromatyczne i że są dwa. Dlatego są to dwie grupy metylowe -CH3 przyłączony do azotu, który również zawiera wodór (H).
W cząsteczce dimetyloaminy azot (N) ma parę wolnych elektronów, czyli parę elektronów niezwiązanych z żadnym innym atomem..
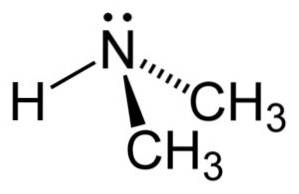
Nomenklatura
- Dimetyloamina
- N, N-dimetyloamina
- N-metylometanamina
- DMA (akronim dla di-metylo-aminy).
Nieruchomości
Stan fizyczny
Bezbarwny gaz.
Waga molekularna
45,08 g / mol
Temperatura topnienia
-93 ºC
Temperatura wrzenia
7,3 ° C
Temperatura zapłonu
-6,69 ºC (metoda zamkniętego tygla).
Temperatura samozapłonu
400 ° C
Gęstość
Ciecz = 0,6804 g / cm3 przy 0 ºC.
Para = 1,6 (gęstość względna względem powietrza, powietrze = 1).
Rozpuszczalność
Bardzo dobrze rozpuszczalny w wodzie: 163 g / 100 g wody o temperaturze 40 ° C. Rozpuszczalny w etanolu i eterze etylowym.
pH
Wodne roztwory dimetyloaminy są silnie zasadowe.
Stała dysocjacji
K.b = 5,4 x 10-4
pKdo sprzężony kwas = 10,732 w 25 ° C Sprzężonym kwasem jest jon dimetyloamoniowy: (CH3) NHdwa+
Właściwości chemiczne
Ciekła dimetyloamina może atakować niektóre tworzywa sztuczne, gumy i powłoki.
Po rozpuszczeniu w wodzie wolna para elektronów azotu (N) przyjmuje proton (H.+) z wody, pozostawiając wolny OH-, więc tworzy bardzo zasadowe i korozyjne roztwory:
Dimetyloamina + Woda → Jon dimetyloamoniowy + Jon hydroksylowy
(CH3)dwaNH + HdwaO → (CH3)dwaNHdwa+ + O-
Z kwasem azotowym otrzymujesz sól azotanową, czyli azotan dimetyloamoniowy:
Dimetyloamina + kwas azotowy → Azotan dimetyloamoniowy
(CH3)dwaNH + HNO3 → (CH3)dwaNHdwa+NIE3-
Inne właściwości
W niewielkim stężeniu w powietrzu ma zapach rybi, natomiast w dużych stężeniach pachnie jak amoniak (NH3).
Reakcje biochemiczne
W organizmie dimetyloamina może ulegać nitrozowaniu w słabo kwaśnych warunkach, dając dimetylonitrozoaminie związek rakotwórczy (CH3)dwaNIE.
Tworzenie dimetylo nitrozoaminy następuje z dimetyloaminy i azotynu (azotynu sodu) w żołądku (przy pH 5-6) w wyniku działania bakterii w przewodzie pokarmowym. Azotyn sodu jest obecny w niektórych produktach spożywczych.
Dimetyloamina + Azotyn sodu → Dimetylonitrozoamina + Wodorotlenek sodu
(CH3)dwaNH + NaNOdwa → (CH3)dwaN-NO + NaOH
Otrzymywanie
Dimetyloamina jest produkowana w handlu przez reakcję metanolu (CH3OH) z amoniakiem (NH3) w temperaturze 350-450 ° C w obecności katalizatora krzemionkowo-tlenkowego (SiOdwa/DodwaLUB3).
2 CH3OH + NH3 → (CH3)dwaNH + 2 H.dwaLUB
Ponieważ produkuje się również monometyloaminę i trimetyloaminę, oczyszczanie przeprowadza się w szeregu od czterech do pięciu kolumn destylacyjnych..
Obecność w przyrodzie
Dimetyloamina znajduje się w roślinach i zwierzętach. Występuje również naturalnie i obficie w ludzkim moczu.
Szacuje się, że jego obecność u ludzi wynika z faktu, że jest wytwarzana przez określone rodzaje bakterii jelitowych z niektórych związków występujących w żywności.
Niektóre z tych związków to cholina (związek związany z grupą witamin z grupy B) oraz tlenek trimetyloaminy. Uważa się również, że pochodzi on z enzymu, który hamuje tworzenie się tlenku azotu (NO) w organizmie..
Niektóre źródła informacji wskazują, że wzrost dimetyloaminy w moczu spowodowany jest spożyciem ryb i owoców morza, gdzie najwyższe wartości uzyskuje się, gdy spożywa się kalmary, morszczuka, sardynki, włócznika, dorsza, witlinka i rai..

Pacjenci z nadmiarem dimetyloaminy
Uważa się, że dimetyloamina jest toksyną mocznicową, czyli substancją, która może zaszkodzić, jeśli jej stężenie w moczu jest zbyt wysokie. W rzeczywistości bardzo wysokie poziomy dimetyloaminy obserwowano u pacjentów ze schyłkową niewydolnością nerek..
Uważa się, że u tych pacjentów może dojść do przeludnienia bakterii jelitowych, które mogą ją wytwarzać.
Aplikacje
Dimetyloamina lub DMA służy do:
- Przygotowanie innych związków.
- Produkcja rozpuszczalników dimetyloformamidu i dimetyloacetamidu.
- Przyspiesz wulkanizację niektórych gum.
- Podczas opalania usuwaj włosy ze skór.
- Działa jako przeciwutleniacz dla rozpuszczalników.
- Służy jako mineralny środek flotacyjny.
- Hamuje korozję i jako środek przeciwporostowy do rur.
- Działa jako środek powierzchniowo czynny.
- Robić mydła i detergenty.
- Działaj jako chemik tekstylny.
- Działa jako środek przeciwstukowy w paliwach i jako stabilizator benzyny.
- Przygotuj barwniki.
- Absorbuj kwaśne gazy.
- Służy jako paliwo do pestycydów i rakiet.
- Bądź częścią środków do uzdatniania wody.
- Działa jako fungicyd w produktach agrochemicznych.
- Przerwane zastosowania, takie jak wabienie i zabijanie ryjkowców lub owadów atakujących bawełnę.


Ryzyka
Opary dimetyloaminy działają drażniąco na skórę, oczy i drogi oddechowe..
Jeśli wejdzie w kontakt ze skórą w postaci płynnej, może spowodować odmrożenia i oparzenia chemiczne. Jego wdychanie ma niekorzystne skutki zdrowotne.
Gaz DMA jest korozyjny i może tworzyć korozyjne roztwory wodne. Twoje roztwory wodne mogą stać się łatwopalne, jeśli nie zostaną dobrze rozcieńczone..
Dimetyloamina w postaci gazu łatwo zapala się tworząc toksyczne opary tlenków azotu (NOx).
Jeśli pojemnik zawierający ten gaz zostanie wystawiony na działanie ognia lub intensywnego ciepła, może wybuchnąć..
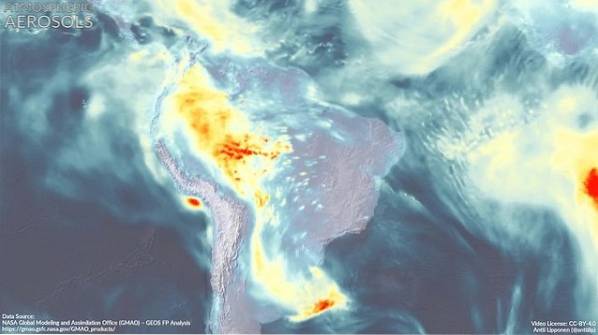
Wpływ DMA na atmosferę
Aerozol atmosferyczny (bardzo małe kropelki mieszaniny naturalnych związków i / lub zanieczyszczeń w atmosferze) ma głęboki wpływ na globalny klimat i jakość powietrza w różnych regionach świata..
Tworzenie nowych cząstek aerozolu nie zostało jeszcze w pełni poznane.
Szacuje się, że dimetyloamina uczestniczy wraz z innymi związkami w powstawaniu tych cząstek, co wydaje się zależeć od tego, że na tym terenie występują silne emisje DMA..
Na przykład na obszarach przemysłowych występuje większa koncentracja niż na obszarach rolniczych, co może wpływać na sposób, w jaki uczestniczy RDW..
Warto zauważyć, że według niektórych naukowców spalanie materiału roślinnego zawierającego glifosat (jeden z najczęściej stosowanych herbicydów na świecie) może prowadzić do powstania dimetyloaminy.
Bibliografia
- NAS. National Library of Medicine. (2019). Dimetyloamina. Odzyskany z pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyklopedia technologii chemicznej. Czwarta edycja. John Wiley & Sons.
- Morrison, R.T. i Boyd, R.N. (2002). Chemia organiczna. 6th Edition. Prentice-Hall.
- Windholz, M. i in. (redaktorzy) (1983). Indeks Merck. Encyklopedia chemikaliów, leków i środków biologicznych. Wydanie dziesiąte. Merck & CO., Inc.
- Abramowitz, M.K. et al. (2010). Patofizjologia mocznicy. Aminy alifatyczne. W przewlekłej chorobie nerek, dializie i przeszczepach (wydanie trzecie). Odzyskany z sciencedirect.com.
- Li, H. i in. (2019). Wpływ warunków atmosferycznych na powstawanie nowych cząstek na bazie kwasu siarkowego, dimetyloaminy i amoniaku. Chemosphere 2019; 245: 125554. Odzyskany z ncbi.nlm.nih.gov.
- Mackie, J.C. i Kennedy, E.M. (2019). Piroliza glifosatu i jego toksycznych produktów. Otaczać. Sci. Technol. 2019: 53 (23): 13742-13747. Odzyskany z ncbi.nlm.nih.gov.



Jeszcze bez komentarzy