
Struktura krystaliczna, rodzaje i przykłady
Plik struktura krystaliczna Jest to jeden ze stanów stałych, które atomy, jony lub cząsteczki mogą przyjąć w przyrodzie, który charakteryzuje się wysokim uporządkowaniem przestrzennym. Innymi słowy, jest to dowód na „korpuskularną architekturę”, która definiuje wiele ciał o szklistym i błyszczącym wyglądzie..
Co sprzyja lub jaka siła odpowiada za tę symetrię? Cząsteczki nie są same, ale oddziałują ze sobą. Te interakcje pochłaniają energię i wpływają na stabilność ciał stałych, tak że cząstki starają się dostosować do siebie, aby zminimalizować tę utratę energii..

Tak więc ich wewnętrzna natura prowadzi ich do umieszczenia się w najbardziej stabilnym układzie przestrzennym. Na przykład może to być ten, w którym odpychanie między jonami o tych samych ładunkach jest minimalne lub w którym niektóre atomy - takie jak metaliczne - również zajmują największą możliwą objętość w swoich opakowaniach..
Słowo „kryształ” ma znaczenie chemiczne, które może być błędnie interpretowane w przypadku innych ciał. Chemicznie odnosi się do uporządkowanej struktury (mikroskopowo), która na przykład może składać się z cząsteczek DNA (kryształu DNA).
Jednak jest on powszechnie nadużywany w odniesieniu do jakiegokolwiek szklistego przedmiotu lub powierzchni, takich jak lustra lub butelki. W przeciwieństwie do prawdziwych kryształów, szkło składa się z amorficznej (nieuporządkowanej) struktury krzemianów i wielu innych dodatków..
Indeks artykułów
- 1 Struktura
- 1.1 Komórka elementarna
- 2 rodzaje
- 2.1 Zgodnie z jego systemem krystalicznym
- 2.2 Zgodnie z jego naturą chemiczną
- 3 przykłady
- 3.1 K2Cr2O7 (system trójskośny)
- 3,2 NaCl (system sześcienny)
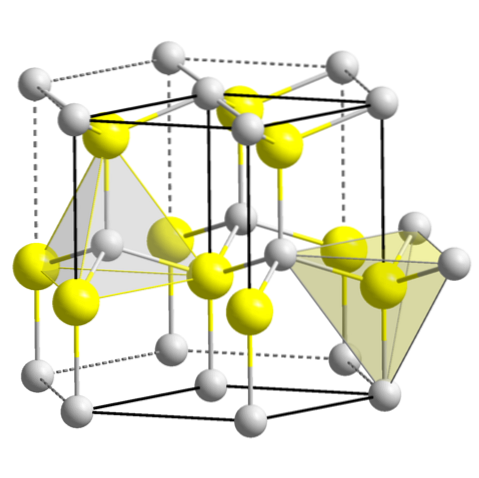
- 3,3 ZnS (wurtzyt, układ heksagonalny)
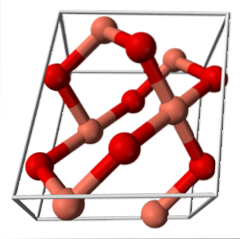
- 3,4 CuO (system jednoskośny)
- 4 Odnośniki
Struktura
Na powyższym obrazku przedstawiono niektóre szmaragdowe klejnoty. Podobnie jak te, wiele innych minerałów, soli, metali, stopów i diamentów wykazuje strukturę krystaliczną; ale jaki związek ma jego uporządkowanie z symetrią?
Jeśli kryształ, którego cząstki można było obserwować gołym okiem, zastosuje się operacje symetrii (odwróć go, obróć pod różnymi kątami, odbij w płaszczyźnie itp.), To okaże się, że pozostaje nienaruszony we wszystkich wymiarach przestrzeni..
Odwrotna sytuacja zachodzi w przypadku amorficznego ciała stałego, z którego uzyskuje się różne rzędy poddając je operacji symetrii. Ponadto brakuje mu strukturalnych wzorców powtarzalności, co wskazuje na losowość w rozmieszczeniu jego cząstek..
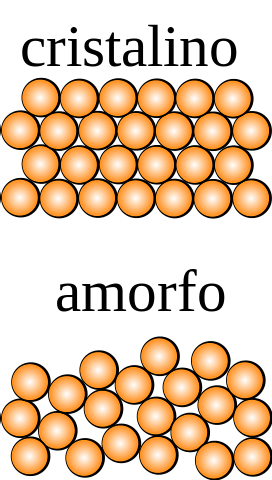
Jaka jest najmniejsza jednostka, która tworzy wzór strukturalny? Na górnym obrazku krystaliczna bryła jest symetryczna w przestrzeni, podczas gdy amorficzna nie..
Gdyby narysować kwadraty, które obejmowałyby pomarańczowe kule i zastosowano do nich operacje symetrii, okazałoby się, że generują one inne części kryształu.
Powyższe powtarza się z coraz mniejszymi kwadratami, aż do znalezienia tego, który jest asymetryczny; ten, który poprzedza go rozmiarem, jest z definicji komórką elementarną.
Komórka elementarna
Komórka elementarna jest minimalną ekspresją strukturalną, która umożliwia pełną reprodukcję krystalicznej substancji stałej. Z tego można zmontować szkło, przesuwając je we wszystkich kierunkach przestrzeni.
Można ją traktować jako małą szufladę (kufer, wiadro, pojemnik itp.), W której cząstki reprezentowane przez kulki są umieszczane zgodnie z wzorem wypełnienia. Wymiary i geometrie tego pudełka zależą od długości jego osi (a, b i c), a także kątów między nimi (α, β i γ).
Najprostszą ze wszystkich komórek elementarnych jest prosta struktura sześcienna (górny obraz (1)). W tym przypadku środek kul zajmuje rogi sześcianu, cztery u podstawy i cztery na suficie..
W tym układzie kule zajmują tylko 52% całkowitej objętości sześcianu, a ponieważ natura nie znosi próżni, niewiele związków lub pierwiastków przyjmuje taką strukturę..
Jeśli jednak kule są ułożone w tej samej kostce w taki sposób, że zajmują środek (sześciennie wyśrodkowany w korpusie, bcc), wówczas opakowanie będzie bardziej zwarte i wydajne (2). Teraz kule zajmują 68% całkowitej objętości.
Z drugiej strony w (3) żadna kula nie zajmuje środka sześcianu, ale środek jego ścian i wszystkie zajmują do 74% całkowitej objętości (powierzchnia sześcienna, cc).
Można więc zauważyć, że dla tej samej kostki można uzyskać inne układy, zmieniając sposób upakowania kulek (jony, cząsteczki, atomy itp.).
Rodzaje
Struktury kryształów można klasyfikować według ich układów krystalicznych lub chemicznej natury ich cząstek..
Na przykład, system sześcienny jest najpowszechniejszym ze wszystkich i rządzi nim wiele krystalicznych ciał stałych; Jednak ten sam system dotyczy zarówno kryształów jonowych, jak i metalicznych..
Zgodnie z jego systemem krystalicznym
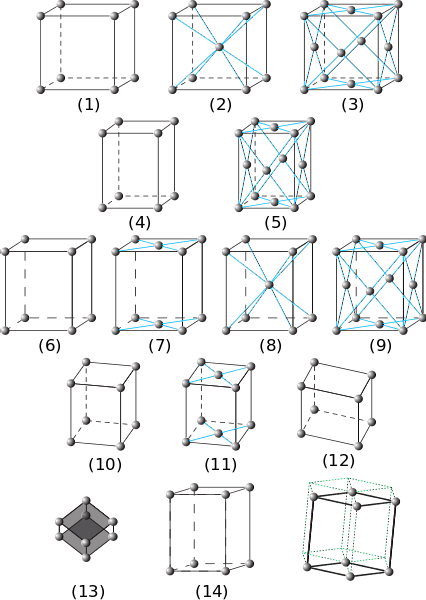
Na poprzednim obrazie przedstawiono siedem głównych układów kryształów. Można zauważyć, że w rzeczywistości jest ich czternaście, które są produktem innych form pakowania dla tych samych systemów i tworzą sieci Bravais..
Od (1) do (3) to kryształy z sześciennymi układami kryształów. W (2) obserwuje się (przez niebieskie paski), że kula w środku i te z rogów oddziałują z ośmioma sąsiadami, więc kule mają liczbę koordynacyjną 8. A w (3) liczba koordynacyjna wynosi 12 ( aby to zobaczyć, musisz zduplikować sześcian w dowolnym kierunku).
Elementy (4) i (5) odpowiadają prostym i skupionym na twarzy układom tetragonalnym. W przeciwieństwie do sześciennych, jego oś c jest dłuższa niż osie a i b.
Od (6) do (9) to układy rombowe: od prostych i wyśrodkowanych na podstawach (7), do tych, które są wyśrodkowane na ciele i na twarzach. W tych α, β i γ wynoszą 90º, ale wszystkie boki mają różne długości.
Ryciny (10) i (11) to kryształy jednoskośne, a (12) to kryształy trójskośne, ostatnia z nierównościami we wszystkich kątach i osiach..
Element (13) to układ romboedryczny, analogiczny do sześciennego, ale o kącie γ różnym od 90º. Wreszcie są sześciokątne kryształy
Przemieszczenia elementów (14) zapoczątkowują sześciokątny pryzmat zaznaczony zielonymi liniami przerywanymi.
Zgodnie ze swoim chemicznym charakterem
- Jeśli kryształy zbudowane są z jonów, to są to kryształy jonowe obecne w solach (NaCl, CaSO)4, CuCldwa, KBr itp.)
- Cząsteczki, takie jak glukoza, tworzą (jeśli tylko mogą) kryształy molekularne; w tym przypadku słynne kryształy cukru.
- Atomy, których wiązania są zasadniczo kowalencyjne, tworzą kowalencyjne kryształy. Tak jest w przypadku diamentu lub węglika krzemu.
- Ponadto metale, takie jak złoto, tworzą zwarte struktury sześcienne, które stanowią kryształy metaliczne..
Przykłady
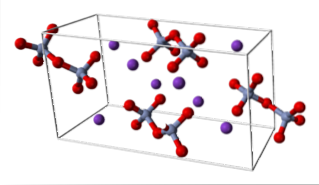
K.dwaCrdwaLUB7 (system trójkliniczny)
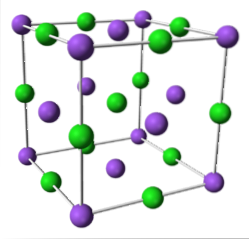
NaCl (system sześcienny)
ZnS (wurtzyt, układ heksagonalny)
CuO (system jednoskośny)
Bibliografia
- Quimitube. (2015). Dlaczego „kryształy” nie są kryształami. Pobrane 24 maja 2018 r. Z: quimitube.com
- Pressbooki. 10.6 Struktury kratowe w krystalicznych ciałach stałych. Pobrane 26 maja 2018 z: opentextbc.ca
- Centrum zasobów akademickich Crystal Structures. [PDF]. Pobrane 24 maja 2018 r. Z: web.iit.edu
- Ming. (30 czerwca 2015). Rodzaje struktur krystalicznych. Pobrane 26 maja 2018 z: crystalvisions-film.com
- Helmenstine, dr Anne Marie (31 stycznia 2018). Rodzaje kryształów. Pobrane 26 maja 2018 r.Z: thinkco.com
- KHI. (2007). Struktury krystaliczne. Pobrane 26 maja 2018 z: folk.ntnu.no
- Paweł Maliszczak. (25 kwietnia 2016). Szmaragdowe kryształy z doliny Panjshir w Afganistanie. [Postać]. Pobrane 24 maja 2018 z: commons.wikimedia.org
- Napy1kenobi. (26 kwietnia 2008). Kraty Bravais. [Postać]. Pobrane 26 maja 2018 z: commons.wikimedia.org
- Użytkownik: Sbyrnes321. (21 listopada 2011). Krystaliczny lub bezpostaciowy. [Postać]. Pobrane 26 maja 2018 z: commons.wikimedia.org



Jeszcze bez komentarzy