
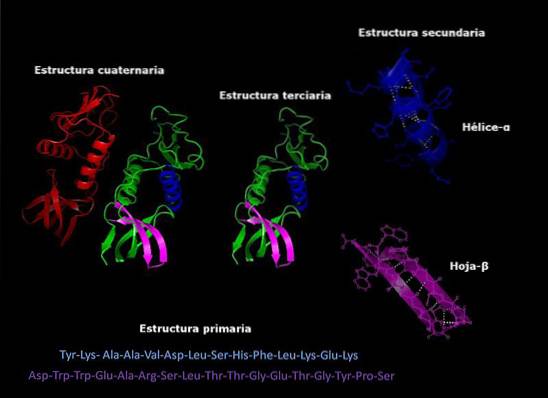
Pierwotna budowa charakterystycznych białek
Plik struktura podstawowa białek Jest to kolejność, w jakiej ułożone są aminokwasy polipeptydu lub polipeptydów, które je zawierają. Białko to biopolimer złożony z monomerów α-aminokwasów połączonych wiązaniami peptydowymi. Każde białko ma określoną sekwencję tych aminokwasów.
Białka pełnią różnorodne funkcje biologiczne, w tym kształtują i utrzymują integralność komórek poprzez cytoszkielet, chronią organizm przed czynnikami obcymi za pośrednictwem przeciwciał oraz katalizują reakcje chemiczne w organizmie za pośrednictwem enzymów..
Dziś określenie składu białek i kolejności ułożenia aminokwasów (sekwencjonowanie) jest szybsze niż przed laty. Informacje te są deponowane w międzynarodowych elektronicznych bazach danych, do których można uzyskać dostęp przez Internet (m.in. GenBank, PIR).
Indeks artykułów
- 1 Aminokwasy
- 1.1 Aminokwasy alifatyczne
- 1.2 Aminokwasy z łańcuchami bocznymi zawierającymi hydroksyl lub siarkę
- 1.3 Cykliczne aminokwasy
- 1.4 Aminokwasy aromatyczne
- 1.5 Podstawowe aminokwasy
- 1.6 Kwaśne aminokwasy i ich amidy
- 2 wiązania peptydowe
- 3 Sekwencja aminokwasów
- 4 Kodowanie białek
- 5 Referencje
Aminokwasy
Aminokwasy to cząsteczki zawierające grupę aminową i grupę kwasu karboksylowego. W przypadku α-aminokwasów posiadają centralny atom węgla (węgiel α), do którego jest przyłączona zarówno grupa aminowa, jak i karboksylowa, a także atom wodoru i charakterystyczną grupę R, zwaną łańcuchem bocznym.
Ze względu na tę konfigurację węgla α powstające aminokwasy, znane jako α-aminokwasy, są chiralne. Powstają dwie formy, które są wzajemnymi odbiciami lustrzanymi i nazywane są enancjomerami L i D..
Wszystkie białka istot żywych składają się z 20 α-aminokwasów o konfiguracji L. Łańcuchy boczne tych 20 aminokwasów są różne i mają dużą różnorodność grup chemicznych.
Zasadniczo α-aminokwasy można pogrupować (arbitralnie) w zależności od typu łańcucha bocznego w następujący sposób.
Aminokwasy alifatyczne
W tej grupie, zdaniem niektórych autorów, znajdują się glicyna (Gli), alanina (Ala), walina (Val), leucyna (Leu) i izoleucyna (Ile). Inni autorzy to również metionina (Met) i Proline (Pro).
Aminokwasy z łańcuchami bocznymi zawierającymi hydroksyl lub siarkę
Zawiera serynę (Ser), cysteinę (Cys), treoninę (Thr), a także metioninę. Według niektórych autorów w skład grupy powinny wchodzić tylko Ser i Thr.
Aminokwasy cykliczne
Składa się wyłącznie z Proline, która, jak już wspomniano, jest zaliczana przez innych autorów do aminokwasów alifatycznych.
Aminokwasy aromatyczne
Fenyloalanina (Phe), tyrozyna (Tyr) i tryptofan (Trp).
Podstawowe aminokwasy
Histydyna (His), Lizyna (Lys) i Arginina (Arg)
Kwaśne aminokwasy i ich amidy
Zawiera kwasy asparaginowy (Asp) i glutaminowy (Glu), a także amidy asparginy (Asn) i glutaminy (Gln). Niektórzy autorzy dzielą tę ostatnią grupę na dwie; z jednej strony aminokwasów kwaśnych (pierwsze dwa), z drugiej takich, które zawierają karboksyloamid (pozostałe dwa).
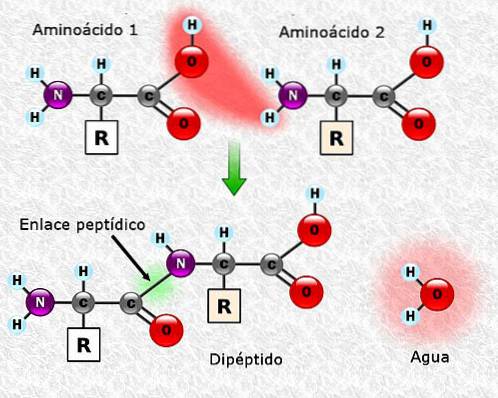
Wiązania peptydowe
Aminokwasy można łączyć ze sobą za pomocą wiązań peptydowych. Wiązania te, nazywane również wiązaniami amidowymi, powstają między grupą a-aminową jednego aminokwasu i grupą a-karboksylową drugiego. To połączenie powstaje z utratą cząsteczki wody.
Połączenie między dwoma aminokwasami skutkuje utworzeniem dipeptydu, a jeśli zostaną dodane nowe aminokwasy, tripeptydy, tetrapeptydy i tak dalej mogą powstawać sekwencyjnie.
Polipeptydy składające się z niewielkiej liczby aminokwasów są ogólnie nazywane oligopeptydami, a jeśli liczba aminokwasów jest wysoka, nazywa się je polipeptydami..
Każdy aminokwas dodany do łańcucha polipeptydowego uwalnia jedną cząsteczkę wody. Część aminokwasu, która utraciła H + lub OH- podczas zrostu, nazywana jest resztą aminokwasową.
Większość z tych łańcuchów oligopeptydowych i polipeptydowych będzie miała na jednym końcu grupę N-końcową (N-końcową), a na drugim końcową grupę karboksylową (C-końcową). Ponadto mogą zawierać wiele grup jonizowalnych między łańcuchami bocznymi reszt aminokwasowych, które je tworzą. Z tego powodu są uważane za poliampolity.
Sekwencja aminokwasów
Każde białko ma określoną sekwencję reszt aminokwasowych. Ta kolejność jest tak zwana podstawową strukturą białka..
Każde białko w każdym organizmie jest specyficzne dla gatunku. Oznacza to, że mioglobina istoty ludzkiej jest identyczna z mioglobiną innej istoty ludzkiej, ale ma niewielkie różnice w porównaniu z mioglobiną innych ssaków..
Ilość i rodzaje aminokwasów, które zawiera białko, są równie ważne, jak umiejscowienie tych aminokwasów w łańcuchu polipeptydowym. Aby zrozumieć białka, biochemicy muszą najpierw wyizolować i oczyścić każde z nich, następnie przeprowadzić analizę zawartości aminokwasów i ostatecznie określić ich sekwencję..
Do izolowania i oczyszczania białek stosuje się różne metody, wśród których są: wirowanie, chromatografia, filtracja żelowa, dializa i ultrafiltracja, a także wykorzystanie właściwości rozpuszczalności badanego białka..
Oznaczenie aminokwasów obecnych w białkach przeprowadza się w trzech etapach. Pierwszym jest zerwanie wiązań peptydowych przez hydrolizę. Następnie rozdziela się różne typy aminokwasów w mieszaninie; i na koniec określa się ilościowo każdy z typów otrzymanych aminokwasów.
Aby określić pierwotną strukturę białka, można zastosować różne metody; ale obecnie najpowszechniej stosowana jest metoda Edmana, która zasadniczo polega na wielokrotnym oznaczaniu i oddzielaniu N-końcowego aminokwasu od reszty łańcucha oraz identyfikacji każdego uwolnionego aminokwasu indywidualnie.
Kodowanie białek
Podstawowa struktura białek jest zakodowana w genach organizmów. Informacja genetyczna jest zawarta w DNA, ale aby dokonać translacji na białka, należy ją najpierw przepisać na cząsteczki mRNA. Każdy tryplet nukleotydów (kodon) koduje aminokwas.
Ponieważ istnieje 64 możliwych kodonów i tylko 20 aminokwasów jest używanych w konstrukcji białek, każdy aminokwas może być kodowany przez więcej niż jeden kodon. Praktycznie wszystkie żywe istoty używają tych samych kodonów do kodowania tych samych aminokwasów. Dlatego kod genetyczny jest uważany za język prawie uniwersalny.
W tym kodzie są kodony używane do rozpoczęcia i zatrzymania translacji polipeptydu. Kodony stop nie kodują żadnego aminokwasu, ale zatrzymują translację na końcu C łańcucha i są reprezentowane przez triplety UAA, UAG i UGA..
Z drugiej strony, kodon AUG normalnie działa jako sygnał startu, a także jako kody dla metioniny..
Po translacji białka mogą zostać poddane pewnej obróbce lub modyfikacji, takiej jak skrócenie przez fragmentację, aby osiągnąć ostateczną konfigurację.
Bibliografia
- C.K. Mathews, K.E. van Holde & K.G. Ahern. 2002. Biochemestry. 3th wydanie. Wydawnictwo Benjamin / Cummings, Inc..
- Murray, P. Mayes, D.C. Granner & V.W. Rodwell. 1996. Biochemestry Harpera. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & L. Stryer (nd). Biochemestry. 5th wydanie. W. H. Freeman and Company.
- J. Koolman & K.-H. Roehm (2005). Color Atlas of Biochemistry. dwand wydanie. Thieme.
- A. Lehninger (1978). Biochemia. Ediciones Omega, S.A..
- L. Stryer (1995). Biochemestry. W.H. Freeman and Company, Nowy Jork.

Jeszcze bez komentarzy