
Historia, opis i wnioski eksperymentu Rutherforda
Plik Eksperyment Rutherforda, przeprowadzona w latach 1908-1913 polegała na bombardowaniu cienkiej złotej folii o grubości 0,0004 mm cząstkami alfa i analizie wzoru dyspersji, jaki te cząstki pozostawiły na ekranie fluorescencyjnym.
W rzeczywistości Rutherford przeprowadził liczne eksperymenty, coraz bardziej dopracowując szczegóły. Po dokładnej analizie wyników wyłoniły się dwa bardzo ważne wnioski:
-Dodatni ładunek atomu jest skoncentrowany w obszarze zwanym rdzeń.
-To jądro atomowe jest niewiarygodnie małe w porównaniu z rozmiarem atomu.
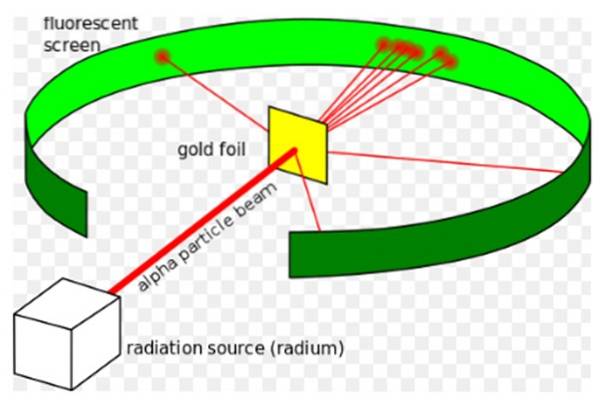
Ernest Rutherford (1871-1937) był fizykiem urodzonym w Nowej Zelandii, którego obszarem zainteresowań była radioaktywność i natura materii. Promieniotwórczość była niedawnym zjawiskiem, kiedy Rutherford rozpoczął swoje eksperymenty, odkrył ją Henri Becquerel w 1896 roku.
W 1907 roku Rutherford udał się na Uniwersytet w Manchesterze w Anglii, aby zbadać strukturę atomu, używając tych cząstek alfa jako sond do zajrzenia do wnętrza tak maleńkiej struktury. W zadaniu towarzyszyli mu fizycy Hans Geiger i Ernest Marsden..
Mieli nadzieję zobaczyć, jak cząstka alfa, która jest podwójnie zjonizowanym atomem helu, oddziałuje z pojedynczym atomem złota, aby upewnić się, że wszelkie odchylenia, których doświadczyła, były spowodowane wyłącznie siłą elektryczną..
Jednak większość cząstek alfa przeszła przez złotą folię z niewielkim odchyleniem..
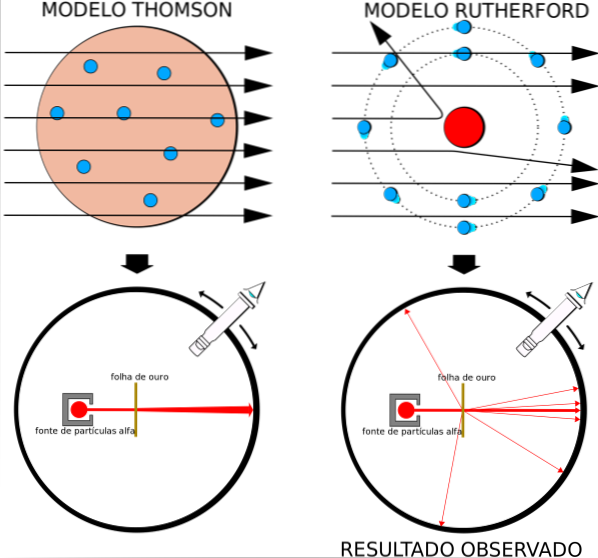
Fakt ten był całkowicie zgodny z modelem atomowym Thomsona, jednak ku zdziwieniu badaczy niewielki procent cząstek alfa doświadczył dość niezwykłego odchylenia..
Jeszcze mniejszy procent cząstek powróciłby, odbijając się całkowicie z powrotem. Z jakiego powodu były te nieoczekiwane wyniki?
Indeks artykułów
- 1 Opis i wnioski z eksperymentu
- 1.1 Wnioski
- 2 Wpływy na model atomu
- 2.1 Wady modelu Rutherforda
- 2.2 Proton i neutron
- 3 Jak wygląda skala modelu atomu wodoru?
- 4 Model atomowy dzisiaj
- 5 Referencje
Opis i wnioski z eksperymentu
W rzeczywistości cząstki alfa, których Rutherford użył jako sondy, to jądra helu, a wtedy wiadomo było tylko, że te cząstki mają ładunek dodatni. Dziś wiadomo, że cząstki alfa składają się z dwóch protonów i dwóch neutronów..
Cząstki alfa i cząstki beta zostały zidentyfikowane przez Rutherforda jako dwa różne rodzaje promieniowania uranu. Cząsteczki alfa, znacznie masywniejsze niż elektron, mają dodatni ładunek elektryczny, podczas gdy cząstki beta mogą być elektronami lub pozytonami..
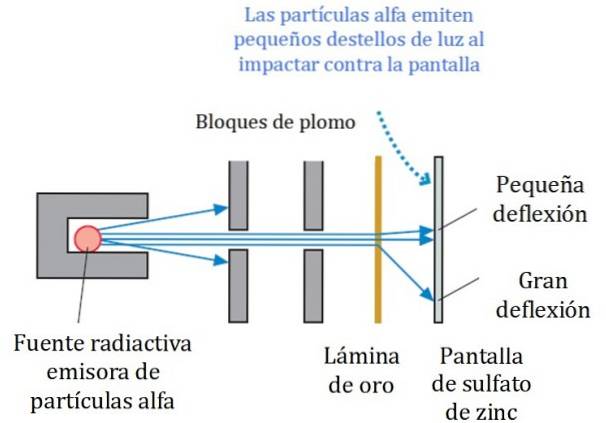
Uproszczony schemat eksperymentu przedstawiono na rysunku 2. Wiązka cząstek alfa pochodzi ze źródła radioaktywnego. Geiger i Marsden używali radonu jako emitera.
Bloki ołowiu zostały użyte do skierowania promieniowania w stronę złotej folii i zapobieżenia jego bezpośredniemu skierowaniu na ekran fluorescencyjny. Ołów to materiał pochłaniający promieniowanie.
Wiązka skierowana w ten sposób została następnie skierowana na cienką złotą folię, a większość cząstek kontynuowała drogę do ekranu fluorescencyjnego z siarczanu cynku, gdzie pozostawiły niewielki ślad świetlny. Geiger był odpowiedzialny za liczenie ich jeden po drugim, chociaż później zaprojektowali urządzenie, które to zrobiło.
Fakt, że niektóre cząstki uległy niewielkiemu ugięciu, nie zaskoczył Rutherforda, Geigera i Marsdena. W końcu na atomie są ładunki dodatnie i ujemne, które wywierają siły na cząstki alfa, ale ponieważ atom jest obojętny, o czym już wiedzieli, odchylenia musiały być niewielkie..
Zaskoczeniem eksperymentu jest to, że kilka pozytywnych cząstek odbiło się prawie bezpośrednio z powrotem..
Wnioski
Około 1 na 8000 cząstek alfa było odchylanych pod kątem większym niż 90º. Niewiele, ale wystarczy, by zakwestionować kilka rzeczy.
Modnym modelem atomowym był budyń rodzynkowy Thomsona, byłego profesora Rutherforda w Cavendish Laboratory, ale Rutherford zastanawiał się, czy pomysł atomu bez jądra iz elektronami osadzonymi w rodzynkach był słuszny..
Ponieważ okazuje się, że te duże ugięcia cząstek alfa i fakt, że kilka z nich jest w stanie powrócić, można wyjaśnić tylko wtedy, gdy atom ma małe, ciężkie, dodatnie jądro. Rutherford założył, że tylko elektryczne siły przyciągania i odpychania, jak wskazuje prawo Coulomba, były odpowiedzialne za wszelkie odchylenia..
Kiedy niektóre cząstki alfa zbliżają się bezpośrednio do tego jądra i ponieważ siła elektryczna zmienia się wraz z odwrotnością kwadratu odległości, odczuwają odpychanie, które powoduje ich rozproszenie szerokokątne lub odchylenie do tyłu..
Oczywiście Geiger i Marsden eksperymentowali, bombardując arkusze różnych metali, nie tylko złota, chociaż ten metal był najbardziej odpowiedni ze względu na jego plastyczność, aby stworzyć bardzo cienkie arkusze..
Uzyskując podobne wyniki, Rutherford był przekonany, że ładunek dodatni w atomie powinien znajdować się w jądrze, a nie rozproszony w całej jego objętości, jak postulował Thomson w swoim modelu..
Z drugiej strony, ponieważ ogromna większość cząstek alfa przeszła bez odchyleń, jądro musiało być bardzo, bardzo małe w porównaniu z wielkością atomu. Jednak to jądro musiało skoncentrować większość masy atomu.
Wpływy na model atomu
Wyniki bardzo zaskoczyły Rutherforda, który na konferencji w Cambridge oświadczył: „… To tak, jakbyś wystrzelił 15-calową kulę armatnią w bibułkę, a pocisk odbijał się prosto w ciebie i trafiał.".
Ponieważ wyników tych nie można wytłumaczyć modelem atomowym Thomsona, Rutherford zaproponował, że atom składa się z jądra, bardzo małego, bardzo masywnego i naładowanego dodatnio. Elektrony pozostawały na orbitach wokół niego, jak miniaturowy układ słoneczny.
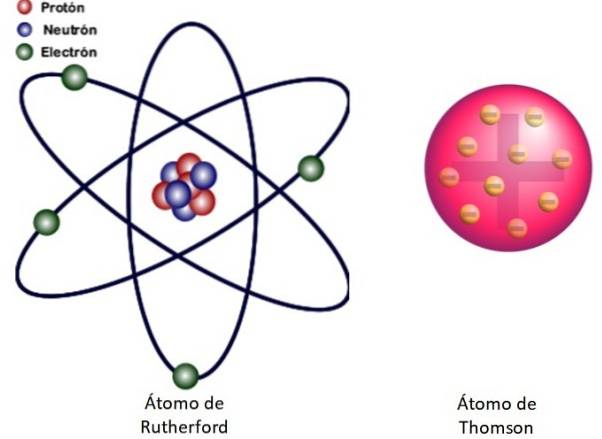
O to właśnie chodzi w jądrowym modelu atomu pokazanym na rysunku 3 po lewej stronie. Ponieważ elektrony są również bardzo, bardzo małe, okazuje się, że atom jest prawie wszystkim…. pusty! Dlatego większość cząstek alfa przechodzi przez arkusz ledwo odchylony..
A analogia z miniaturowym układem słonecznym jest bardzo dokładna. Jądro atomowe pełni rolę Słońca i zawiera prawie całą masę plus ładunek dodatni. Elektrony krążą wokół nich jak planety i niosą ładunek ujemny. Zespół jest elektrycznie neutralny.
Jeśli chodzi o rozmieszczenie elektronów w atomie, eksperyment Rutherforda niczego nie wykazał. Można by pomyśleć, że cząstki alfa miałyby z nimi jakąś interakcję, ale masa elektronów jest zbyt mała i nie były one w stanie znacząco odchylić cząstek..
Wady modelu Rutherforda
Jednym z problemów z tym modelem atomowym było właśnie zachowanie elektronów.
Gdyby nie były one statyczne, lecz krążące wokół jądra atomowego po orbitach kołowych lub eliptycznych, kierowane przez przyciąganie elektryczne, spadłyby w kierunku jądra..
Dzieje się tak, ponieważ przyspieszone elektrony tracą energię, a jeśli tak się stanie, byłoby to zapadnięciem się atomu i materii..
Na szczęście tak się nie dzieje. Istnieje pewna dynamiczna stabilność, która zapobiega zapadaniu się. Kolejnym modelem atomowym, po Rutherforda, był model Bohra, który dał kilka odpowiedzi na pytanie, dlaczego rozpad atomu nie występuje.
Proton i neutron
Rutherford kontynuował eksperymenty z rozpraszaniem. W latach 1917-1918 on i jego asystent William Kay zdecydowali się bombardować gazowe atomy azotu wysokoenergetycznymi cząstkami alfa z bizmutu-214..
Znowu był zaskoczony, gdy wykrył jądra wodoru. Oto równanie reakcji, pierwszej kiedykolwiek osiągniętej sztucznej transmutacji jądrowej:
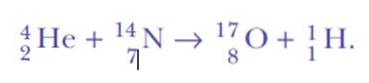
Odpowiedź brzmiała: z tego samego azotu. Rutherford przypisał wodórowi liczbę atomową 1, ponieważ jest to najprostszy pierwiastek ze wszystkich: jądro dodatnie i elektron ujemny.
Rutherford znalazł fundamentalną cząstkę, którą nazwał proton, nazwa wywodząca się od greckiego słowa oznaczającego Pierwszy. W ten sposób proton jest niezbędnym składnikiem każdego jądra atomowego..
Później, około 1920 roku, Rutherford zaproponował, że musi istnieć obojętna cząstka o masie bardzo podobnej do masy protonu. Nazwał tę cząstkę neutron i jest częścią prawie wszystkich znanych atomów. Fizyk James Chadwick ostatecznie zidentyfikował to w 1932 roku.
Jak wygląda skala modelu atomu wodoru?
Jak powiedzieliśmy, atom wodoru jest najprostszy ze wszystkich. Jednak opracowanie modelu tego atomu nie było łatwe..
Kolejne odkrycia dały początek fizyce kwantowej i całej teorii opisującej zjawiska w skali atomowej. Podczas tego procesu ewoluował również model atomowy. Ale spójrzmy na kwestię rozmiarów:
Atom wodoru ma jądro złożone z jednego protonu (dodatniego) i pojedynczego elektronu (ujemnego).
Promień atomu wodoru oszacowano na 2,1 x 10-10 m, podczas gdy proton wynosi 0,85 x 10 -piętnaście m lub 0,85 femtometry. Nazwa tej niewielkiej jednostki pochodzi od Enrico Fermiego i jest często używana podczas pracy w tej skali.
Cóż, iloraz między promieniem atomu i jądra jest rzędu 105 m, czyli atom jest 100 000 razy większy niż jądro!!.
Należy jednak wziąć pod uwagę, że we współczesnym modelu, opartym na mechanice kwantowej, elektron otacza jądro w pewnego rodzaju obłoku zwanym orbitalny (orbital nie jest orbitą), a elektron w skali atomowej nie jest punktualny.
Gdyby atom wodoru został powiększony - w wyobraźni - do rozmiaru boiska piłkarskiego, to jądro złożone z dodatniego protonu byłoby wielkości mrówki w środku pola, a ujemny elektron byłby czymś w rodzaju ducha , rozproszone po całym polu i otaczające dodatni rdzeń.
Model atomowy dzisiaj
Ten model atomu „typu planetarnego” jest bardzo zakorzeniony i stanowi obraz atomu, jaki większość ludzi ma, ponieważ jest on bardzo łatwy do wizualizacji. jednak, Nie jest model przyjęty dziś w nauce.
Współczesne modele atomowe oparte są na mechanice kwantowej. Wskazuje, że elektron w atomie nie jest ujemnie naładowaną kropką poruszającą się po precyzyjnych orbitach, takich jak te, które przewidział Rutherford..
Raczej elektron rozsiany w strefach wokół jądra dodatniego, tzw orbitale atomowe. Od niego możemy wiedzieć prawdopodobieństwo być w takim czy innym stanie.
Mimo to model Rutherforda stanowił ogromny postęp w zrozumieniu wewnętrznej struktury atomu. I to utorowało drogę większej liczbie badaczy, którzy mogliby go dalej udoskonalać..
Bibliografia
- Andriessen, M. 2001. Kurs HSC. Fizyka 2. Jacaranda HSC Science.
- Arfken, G. 1984. Fizyka uniwersytecka. Academic Press.
- Knight, R. 2017. Fizyka dla naukowców i inżynierii: podejście strategiczne. osoba.
- Fizyka OpenLab. Eksperyment Rutherforda-Geigera-Marsdena. Odzyskane z: physicsopenlab.org.
- Rex, A. 2011. Podstawy fizyki. osoba.
- Tyson, T. 2013. The Rutherford Scattering Experiment. Pobrane z: 122.physics.ucdavis.edu.
- Xaktly. Eksperymenty Rutherforda. Odzyskany z: xaktly.com.
- Wikipedia. Eksperyment Rutherforda. Odzyskane z: es.wikipedia.org.


Jeszcze bez komentarzy