
Właściwości, zagrożenia i zastosowania żelazocyjanku potasu
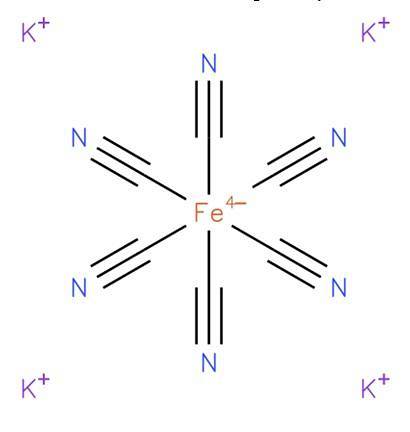
Plik żelazocyjanek potasu, znany również jako heksacyjanożelazian (II) potasu lub żółcień pruska, jest związkiem nieorganicznym o wzorze K4[Wiara (CN)6]. Jest to sól potasowa kompleksu koordynacyjnego żelazocyjanku (Fe (CN)64-) i generalnie występuje w postaci trójwodzianu K4[Wiara (CN)6] · HdwaO. Jego strukturę przedstawiono na rysunku 1 (EMBL-EBI, 2008).
Dawniej był wytwarzany z ekologicznych źródeł dwutlenku węgla, opiłków żelaza i węglanu potasu. Powszechnym źródłem azotu i węgla były odpady skóry, podroby lub zaschnięta krew.
Obecnie żelazocyjanek potasu jest produkowany przemysłowo z cyjanowodoru, chlorku żelazawego i wodorotlenku wapnia, których połączenie daje Cadwa [Wiara (CN) 6] · 11HdwaLUB.
Ten roztwór jest następnie traktowany solami potasowymi w celu wytrącenia mieszanej soli wapniowo-potasowej CaK.dwa [Wiara (CN) 6], który z kolei poddaje się działaniu węglanu potasu, uzyskując sól tetrapotasową.
Indeks artykułów
- 1 Właściwości fizyczne i chemiczne
- 2 Reaktywność i zagrożenia
- 2.1 Kontakt z oczami
- 2.2 Kontakt ze skórą
- 2.3 Wdychanie
- 2.4 Połknięcie
- 3 Zastosowania
- 3.1 1- Przemysł spożywczy
- 3.2 2- Przemysł górniczy i metalurgiczny
- 3.3 3- Odczynnik laboratoryjny
- 4 Odnośniki
Fizyczne i chemiczne właściwości
Żelazocyjanek potasu jest jednoskośnym kryształem o barwie żółtej lub bladożółtej, w zależności od stopnia nawodnienia, bez charakterystycznego aromatu (National Center for Biotechnology Information., 2017). Jego wygląd pokazano na rysunku 2 (żelazocyjanek potasu, 2017).

Związek ma masę cząsteczkową 368,35 g / mol w postaci bezwodnej i 422,388 g / mol w postaci trihydratu. Ma gęstość 1,85 g / ml i temperaturę topnienia 70 ° C, w której zaczyna się rozkładać (Royal Society of Chemistry, 2015).
Związek jest rozpuszczalny w wodzie, będąc w stanie rozpuścić 28,9 gramów związku w 100 ml tego rozpuszczalnika. Jest nierozpuszczalny w eterze dietylowym, etanolu i toluenie. Związek reaguje na ciepło, tworząc cyjanek potasu zgodnie z reakcją:
K.4[Wiara (CN)6] → 4 KCN + FeCdwa + Ndwa
W połączeniu ze stężonymi kwasami tworzy cyjanowodór (HCN), który jest silnie trującym, łatwopalnym gazem i może tworzyć wybuchowe mieszaniny w powietrzu (Laffort, 2001).
Reaktywność i zagrożenia
Żelazocyjanek potasu jest związkiem stabilnym, niekompatybilnym z silnymi kwasami i utleniaczami. Żelazocyjanek potasu jest nietoksyczny i nie rozkłada się w organizmie na cyjanek. Toksyczność u szczurów jest niska, przy dawce śmiertelnej (LD50) wynoszącej 6400 mg / kg.
Substancja jest toksyczna dla płuc i błon śluzowych. Związek może powodować podrażnienia w przypadku kontaktu ze skórą i oczami..
Połknięty może powodować podrażnienia przewodu pokarmowego, aw przypadku wdychania podrażnienia błony śluzowej nosa i układu oddechowego..
Kontakt z oczami może spowodować uszkodzenie rogówki lub ślepotę. Kontakt ze skórą może powodować stan zapalny i pęcherze.
Wdychanie pyłu powoduje podrażnienie przewodu pokarmowego lub dróg oddechowych, objawiające się pieczeniem, kichaniem i kaszlem. Poważne nadmierne narażenie może spowodować uszkodzenie płuc, uduszenie, utratę przytomności lub śmierć..
Kontakt wzrokowy
W przypadku kontaktu z oczami należy sprawdzić i zdjąć soczewki kontaktowe. Oczy należy natychmiast przemywać dużą ilością zimnej wody przez co najmniej 15 minut.
Kontakt ze skórą
Zaatakowany obszar należy natychmiast spłukać dużą ilością wody przez co najmniej 15 minut, zdejmując skażoną odzież i buty. Pokryj podrażnioną skórę emolientem.
Wyprać ubranie i buty przed ponownym użyciem. W przypadku silnego kontaktu przemyć mydłem dezynfekującym, a skażoną skórę pokryć kremem antybakteryjnym.
Inhalacja
Ofiarę należy przenieść w chłodne miejsce. Jeśli nie oddycha, należy zastosować sztuczne oddychanie. Jeśli oddychanie jest utrudnione, podaj tlen.
Przyjmowanie pokarmu
W przypadku spożycia związku nie należy wywoływać wymiotów, chyba że jest to zalecane przez personel medyczny. Poluzuj ciasną odzież, taką jak kołnierzyk koszuli, pasek lub krawat.
We wszystkich przypadkach należy natychmiast uzyskać pomoc lekarską (Karta charakterystyki substancji niebezpiecznej trójwodzian żelazocyjanku potasu, 2013).
Aplikacje
1- Przemysł spożywczy
Żółcień pruska jest również znana ze swojego zatwierdzonego europejskiego numeru dodatku do żywności: E536 i ma różne zastosowania w przemyśle spożywczym. Jest stosowany jako środek przeciwzbrylający zarówno do soli drogowej, jak i kuchennej.
Ma również zastosowanie enologiczne do usuwania miedzi i żelaza w produkcji wina. Miedź jest używana jako fungicydy w winogronach (Uniwersytet Wageningen, 2014).
Jest również używany do fermentacji kwasu cytrynowego (D. S. Clark, 1965). Żelazocyjanek potasu może być również stosowany jako nawóz dla roślin.
2- Przemysł górniczy i metalurgiczny
Żelazocyjanek potasu służy do usuwania miedzi z minerałów molibdenu. Służy również do cementowania stali (żelazocyjanek potasu, K4Fe (CN) 6, 2012).
Cementowanie to obróbka cieplno-chemiczna wykonywana na częściach stalowych. Proces ten przenosi węgiel na powierzchnię poprzez dyfuzję, który jest impregnowany poprzez modyfikację jego składu.
3- Odczynnik laboratoryjny
Żelazocyjanek potasu służy do określania stężenia nadmanganianu potasu, związku często używanego w miareczkowaniu opartym na reakcjach redoks..
Żelazocyjanek potasu jest stosowany w mieszaninie z żelazicyjankiem potasu i roztworem buforowanym fosforanem, aby zapewnić bufor dla beta-galaktozydazy, który jest używany do rozszczepiania X-Gal (5-bromo-4-chloro-3-indolilo-β-D-galaktopiranozydu dając jasnoniebieską wizualizację, w której przeciwciało (lub inna cząsteczka), sprzężone z Beta-gal, związało się ze swoim celem.
Związek jest również używany do produkcji błękitu pruskiego. Reagując z Fe (III) daje pruski niebieski kolor, dlatego w laboratoriach jest stosowany jako odczynnik do identyfikacji żelaza..
Służy również do oznaczania cynku w próbkach siarczku cynku. Próbkę rozpuszcza się w HCl 6N i gotować pod wyciągiem, aby usunąć siarkowodór, zobojętnić wodorotlenkiem amonu i dodać 3 krople HCl.
Podgrzej do wrzenia i dodaj 5 ml roztworu 1N żelazocyjanku potasu. Obecność białego osadu żelazocyjanku cynku wskazuje na pozytywny wynik testu na ten pierwiastek (Mehlig, 1927).
Bibliografia
- S. Clark, K. I. (1965). Wpływ żelazocyjanku potasu na skład chemiczny zacieru melasowego stosowanego w procesie fermentacji kwasem cytrynowym. Biotechnologia i bioinżynieria tom 7, wydanie 2, 269-278. Odzyskany z onlinelibrary.wiley.com.
- EMBL-EBI. (2008, 16 stycznia). heksacyjanożelazian (4−) potasu. Odzyskany z ebi.ac.uk.
- (2001, 5 marca). ŻELAZA POTASOWA. Odzyskany z laffort.com.
- Karta charakterystyki materiału, trihydrat żelazocyjanku potasu. (2013, 21 maja). Odzyskany z sciencelab.com.
- Mehlig, J. P. (1927). Zastosowanie żelazocyjanku potasu jako testu potwierdzającego obecność cynku. Chem. Educ. 4 (6), 722. Odzyskany z pubs.acs.org.
- National Center for Biotechnology Information… (15 kwietnia 2017). Baza danych PubChem Compound; CID = 161067. Odzyskany z pubchem.ncbi.nlm.nih.gov.
- Żelazocyjanek potasu. (2017, 25 marca). Odzyskany z sciencemadness.org.
- Żelazocyjanek potasu, K4Fe (CN) 6. (2012). Odzyskany z atomistry.com.
- Królewskie Towarzystwo Chemii. (2015). żelazocyjanek potasu. Odzyskany z chemspider.com.
- Uniwersytet Wageningen. (14 sierpnia 2014). E536: żelazocyjanek potasu. Odzyskany z food-info.net.


Jeszcze bez komentarzy