
Minimalna formuła jak uzyskać minimalną formułę, przykłady i ćwiczenia
Plik wzór minimalny lub empiryczny Jest to wyraz proporcji, w jakiej obecne są atomy różnych pierwiastków tworzących związek chemiczny. Minimalny wzór jest zatem najprostszym przedstawieniem związku chemicznego. Dlatego jest „minimalny”.
Wzór minimum nie wyraża liczby atomów różnych pierwiastków tworzących związek chemiczny; ale proporcja, w jakiej te atomy łączą się, tworząc związek chemiczny.
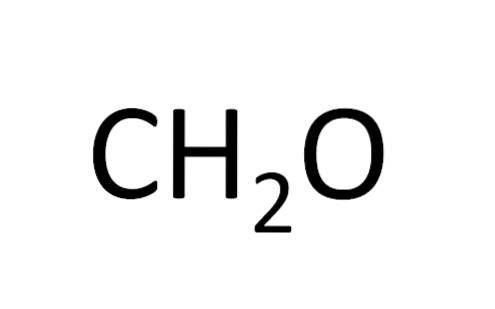
Formuła minimum nazywana jest również formułą empiryczną, ponieważ została uzyskana w wyniku eksperymentów; to znaczy, jest to związane z doświadczeniem. Obserwacje eksperymentalne pozwoliły stwierdzić, że dwa atomy wodoru łączą się z jednym atomem wodoru, tworząc wodę (H.dwaLUB).
W wielu przypadkach minimalny wzór jest zgodny z wzorem cząsteczkowym. W cząsteczce pojawiają się rzeczywiste liczby różnych pierwiastków tworzących związek chemiczny; tak jest na przykład w przypadku kwasu siarkowego (Hdwapołudniowy zachód4).
Ale w innych przypadkach nie ma zbieżności wzoru minimum i wzoru cząsteczkowego; Tak jest w przypadku benzenu: wzór minimum to CH, a wzór cząsteczkowy C6H.6.
Indeks artykułów
- 1 Jak uzyskać formułę minimum?
- 1.1 Pierwszy krok
- 1.2 Drugi krok
- 1.3 Trzeci krok
- 1.4 Czwarty krok
- 2 Przykłady formuły minimum
- 2.1 Woda i dwutlenek węgla
- 2.2 Tlenki zasadowe i kwasowe
- 2.3 Kwas octowy
- 2.4 Kwas masłowy
- 2.5 Glikol etylenowy
- 2,6 benzen
- 2.7 Glukoza
- 3 ćwiczenia rozwiązane
- 3.1 - Ćwiczenie 1
- 3.2 - Ćwiczenie 2
- 4 Odnośniki
Jak uzyskać minimalną formułę?
Pierwszy krok
Znajdź gramy każdego pierwiastka obecnego w związku. Ponieważ są one zwykle wyrażane jako procent masy związku, należy dokonać prostego obliczenia w celu przekształcenia procentowych mas w masie pierwiastków.
Drugi krok
Uzyskuje się względną liczbę atomów różnych pierwiastków tworzących związek chemiczny. Aby to zrobić, masa każdego pierwiastka, wyrażona w gramach, jest podzielona przez jego masę atomową.
Niektórzy autorzy wolą nazywać względną liczbę atomów, jako liczbę moli atomów pierwiastków wchodzących w skład związku chemicznego.
Trzeci krok
Uzyskanie minimalnej ilości wyrażonej w liczbach całkowitych każdego z atomów obecnych w związku chemicznym.
Aby znaleźć te wartości, podziel względne liczby każdego atomu obecnego w związku przez minimalną względną wartość liczbową, jaką atom ma w związku chemicznym..
W przypadku gdy wartość minimalnego udziału atomu nie jest liczbą całkowitą bez miejsc po przecinku, wszystkie wartości minimalnego udziału należy pomnożyć przez liczbę; w taki sposób, aby wszystkie wartości minimalnej proporcji były liczbami całkowitymi.
Na przykład, jeśli wartość minimalnej proporcji atomu związku chemicznego wynosi 2,5, pomnóż wszyscy wartości minimalnego udziału każdego z atomów w czasie obecnym 2. Zatem wszystkie wartości minimalnego udziału będą tylko liczbami całkowitymi.
Czwarty krok
Napisz minimalny wzór związku. Wartości minimalnej proporcji dla atomów różnych pierwiastków zostaną umieszczone jako dolne indeksy symboli chemicznych pierwiastków, aby zapisać minimalny wzór.
Minimalne przykłady formuł
Woda i dwutlenek węgla
Większość związków chemicznych ma wzory zarówno minimalne, jak i molekularne. Zatem wzór na wodę (H.dwaO) to formuła minimalna; ale jest to również wzór cząsteczkowy. To samo dotyczy wzoru na dwutlenek węgla (COdwa).
Tlenki zasadowe i kwasowe
Tlenki zasadowe i kwasowe to związki chemiczne, które mają wzory chemiczne, z nielicznymi wyjątkami, które są zarówno wzorami minimalnymi, jak i cząsteczkowymi. Ta sama sytuacja ma miejsce w przypadku wodorotlenków i kwasów, z wyjątkiem niektórych kwasów karboksylowych..
Kwas octowy
Kwasy karboksylowe, które mają parzystą liczbę atomów węgla w swoim składzie, mają osobno minimalny wzór i wzór cząsteczkowy. Na przykład kwas octowy ma wzór cząsteczkowy (C.dwaH.4LUBdwa); ale ma też minimalną formułę (CHdwaLUB).
Kwas masłowy
Kwas masłowy ma również wzór cząsteczkowy (C4H.8LUBdwa) i minimalną formułę (C.dwaH.4LUB).
Glikol etylenowy
Inne związki organiczne mają oba typy wzorów chemicznych; tak jest w przypadku glikolu etylenowego, który ma wzór cząsteczkowy (CdwaH.6LUBdwa) i minimalną formułę (CH3LUB).
Benzen
Benzen, związek aromatyczny, ma wzór cząsteczkowy (C.6H.6) i minimalną formułę (CH).
Glukoza
Glukoza ma wzór cząsteczkowy (C.6H.12LUB6) i minimalną formułę (CHdwaLUB).
Rozwiązane ćwiczenia
- Ćwiczenie 1
Glikol etylenowy jest związkiem stosowanym jako środek przeciw zamarzaniu, ma masę cząsteczkową 62,1 g / mol i procentowy skład wagowy:
C: 38%,
W: 9,7%
Lub: 51,16%.
Pierwszy krok
Wyraź procenty masowe pierwiastków w ich masach w gramach. W tym celu jako odniesienie przyjmuje się masę cząsteczkową glikolu etylenowego. Jeśli jest to 62,1 grama na mol, 38% składa się z węgla. I tak dalej z innymi elementami:
Masa węgla = 62,1 g (38/100)
= 23,6 g
Masa wodoru = 62,1 g (9,7 / 100)
= 6,024 g
Masa tlenu = 62,1 g (51,16 / 100)
= 31,77 g
Drugi krok
Oblicz względną liczbę każdego obecnego atomu (NRA) lub liczbę moli każdego atomu. Aby to zrobić, masa każdego pierwiastka chemicznego jest podzielona przez jego masę atomową.
NRA (C) = 23,6 g / 12 g
= 1,97
Można zaokrąglić do 2.
NRA (H) = 6,024 g / 1 g
= 6,024
Można zaokrąglić do 6.
NRA (O) = 31,77 g / 16 g
= 1,985
Można zaokrąglić do 2.
Trzeci krok
Oblicz minimalny stosunek liczby całkowitej elementów związku (PMNE). Aby to zrobić, podziel każdą z wartości atomowych liczb względnych (NRA) przez najmniejszą z nich. W tym przypadku 2.
PMNE (C) = 2/2
= 1
PMNE (H) = 6/2
= 3
PMNE (O) = 2/2
= 1
Czwarty krok
Napisz minimalny wzór dla glikolu etylenowego:
CH3LUB
Jak widać, wartości uzyskane w kroku 3 są indeksami dolnymi elementów związku.
- Ćwiczenie 2
Kwas octowy ma masę cząsteczkową 60 g / mol i następujący skład w procentach masowych:
C: 40%
W: 6,67%
Lub: 53,33%
Uzyskaj minimalną formułę związku.
Pierwszy krok
Przekształć procenty masowe pierwiastków na ich masy wyrażone w gramach:
Masa węgla = 60 g (40/100)
= 24 g
Masa wodoru = 60 g (6,67 / 100)
= 4 g
Masa tlenu = 60 g (53,33 / 100)
= 32 g
Drugi krok
Oblicz względną liczbę atomów (NRA) związku. Aby to zrobić, masy pierwiastków są podzielone przez ich masy atomowe:
NRA (C) = 24 g / 12 g
= 2
NRA (H) = 4 g / 1 g
= 4
NRA (O) = 32 g / 16 g
= 2
Trzeci krok
Uzyskać minimalny stosunek liczby całkowitej elementów związku (PMNE). Aby to zrobić, wartości NRA elementów są dzielone przez najniższą wartość NRA, jaką ma element:
PMNE (C) = 2/2
= 1
PMNE (H) = 4/2
= 2
PMNE (O) = 2/2
= 1
Czwarty krok
Napisz minimalny wzór na kwas octowy:
CHdwaLUB
Indeksami dolnymi związku są wartości uzyskane z PMNE.
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Helmenstine, dr Anne Marie (27 sierpnia 2019). Wzór empiryczny: definicja i przykłady. Odzyskany z: thinkco.com
- Wikipedia. (2020). Wzór empiryczny. Odzyskane z: en.wikipedia.org
- Chemia LibreTexts. (03 lipca 2019). Obliczanie wzorów empirycznych dla związków. Źródło: chem.libretexts.org
- Nicola McDougal. (2020). Wzór empiryczny: definicja, kroki i przykłady. Nauka. Odzyskany z: study.com



Jeszcze bez komentarzy