
Właściwości węglowodorów aromatycznych, przykłady, zastosowania

Plik aromatyczne węglowodory lub areny są zbiorem związków organicznych, które składają się wyłącznie z atomów węgla i wodorów i które charakteryzują się posiadaniem pierścieniowych jednostek benzenowych w swoich strukturach molekularnych.
Niektóre, jak podkreśla ich nazwa, wydzielają słodkie i przyjemne zapachy; dlatego pierwsi chemicy organiczni nazywali je aromatami. Na przykład metan jest bezwonnym węglowodorem; podczas gdy toluen, lotna ciecz, ma raczej specyficzny i silny zapach.
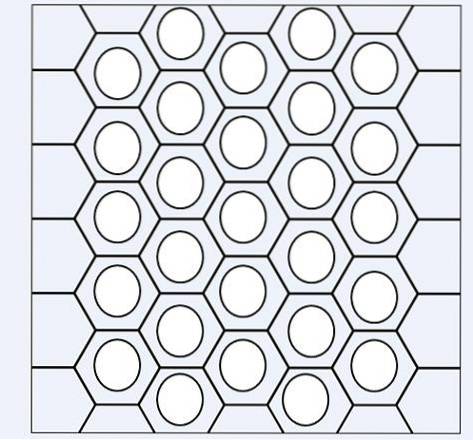
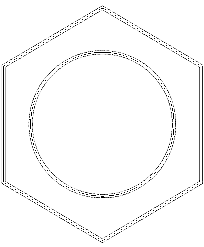
Na powyższym obrazku mamy rodzaj sieci lub siatki złożonej z pierścieni benzenowych. Zwróć uwagę na jego sześciokątną geometrię i okrąg w środku. Ten okrąg reprezentuje to, co jest znane jako aromatyczność, która jest całkowicie chemiczną i niefizyczną właściwością, niezależną od zapachów tych węglowodorów..
Węglowodory aromatyczne należą do najważniejszych substancji wydobywanych lub produkowanych z ropy naftowej i minerałów węglowych. Benzen jest podstawą tych węglowodorów i ich zastosowań, ponieważ pochodzi z niezliczonych związków używanych jako surowiec do produkcji nawozów, tworzyw sztucznych, klejów, detergentów, perfum, leków itp..
Indeks artykułów
- 1 Jak nazywane są węglowodory aromatyczne??
- 1.1 Pojedynczy pierścień benzenowy
- 1.2 Wiele dzwonków
- 2 Właściwości węglowodorów aromatycznych
- 2.1 Aromatyczność
- 2.2 Wysokie współczynniki C / H
- 2.3 Żółte płomienie
- 2.4 Reakcje substytucji
- 2.5 Zapachy
- 3 Przykłady węglowodorów aromatycznych
- 4 Zastosowania / zastosowania
- 4.1 Włókna i tworzywa sztuczne
- 4.2 Żywice epoksydowe
- 4.3 Detergenty
- 4.4 TNT
- 4.5 Kwas benzoesowy
- 4.6 Rozpuszczalniki
- 4.7 Benzyna
- 5 Referencje
Jak nazywa się węglowodory aromatyczne??
Pojedynczy pierścień benzenowy
W przypadku węglowodorów aromatycznych wyróżnia się fakt, że ich nazwy tradycyjne lub pospolite przeważają nad nazwami regulowanymi przez nomenklaturę IUPAC.
Wszystkie zawierają pierścień benzenowy lub pierścień spełniający właściwości aromatyczne. Najprostszy można nazwać na podstawie benzenu i względnych pozycji jego podstawników.
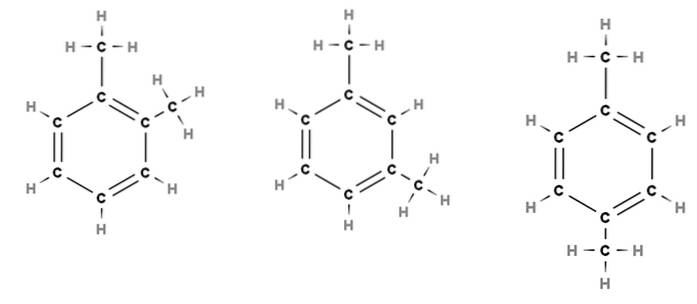
Na przykład rozważ powyższy obrazek. W trzech strukturach widzimy sześciokątny pierścień benzenu, który ma dwa podstawniki metylowe, CH3. Tak więc związek ten nazywany jest dimetylobenzenem, ponieważ składa się z benzenu z dwoma metylami.
Od lewej do prawej widzimy, że separacja między obydwoma CH3 starzeje się, co nie tylko wpływa na właściwości fizyczne cząsteczki, ale także zmienia ich nazwy. Aby je rozróżnić, ponieważ wszystkie nazywane są dimetylobenzenem, używa się przedrostków orto (o-), meta (m-) i para (p-).
Dlatego znowu od lewej do prawej mamy: orto-dimetylobenzen, meta-dimetylobenzen i para-dimetylobenzen. Jednak tradycyjną nazwą tego związku jest ksylen, więc nazywane są: orto-ksylen, meta-ksylen i para-ksylen..
Jeśli jest więcej niż dwa różne podstawniki, węgle są wyliczane zgodnie z tymi samymi regułami nomenklatury, jak dla wszystkich węglowodorów.
Wiele dzwonków
W przypadku węglowodorów aromatycznych z więcej niż jednym pierścieniem benzenowym tradycyjne nazwy stają się jeszcze ważniejsze. Dzieje się tak, ponieważ systematyczne nazwy opisujące ich struktury są uciążliwe i trudne do zapamiętania. Rozważmy przykład naftalenu:
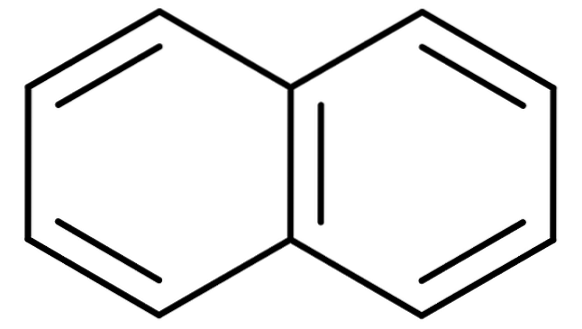
Naftalen jest również znany w handlu jako naftalen lub biała kamfora. Jednak jego nazwa systematyczna to: bicyklo [4,4,0] deka-1,3,5,7,9 pentaen. I to tylko dla związku z dwoma skondensowanymi pierścieniami benzenowymi; nazewnictwo staje się znacznie bardziej skomplikowane w przypadku związków z trzema lub więcej pierścieniami.
Właściwości węglowodorów aromatycznych
Aromatyczność
Węglowodory aromatyczne zawierają pierścienie zgodne z zasadami Huckela. Oznacza to, że ich pierścienie muszą mieć atomy z hybrydyzacjami spdwa, być możliwie jak najbardziej płaskie i mieć liczbę zdelokalizowanych elektronów π równą 4n + 2. Na przykład benzen jest aromatyczny, ponieważ ma 6 zdelokalizowanych elektronów do n= 1 (4 · 1 + 2 = 6).
Wysokie współczynniki C / H
Stosunki C / H węglowodorów aromatycznych są wysokie lub większe niż 1. Na przykład dla benzenu C6H.6, jego C / H jest równe 6/6 lub 1. Podczas gdy w przypadku naftalenu C10H.8, jego C / H jest równe 10/8 lub 1,25. Co to znaczy? Że te węglowodory są silnie „nagazowane” w porównaniu z innymi związkami.
Żółte płomienie
Właśnie ze względu na wysoki stosunek C / H węglowodory aromatyczne podczas spalania wydzielają żółtawy płomień będący produktem powstających cząstek węgla (sadza).
Reakcje substytucji
Węglowodory aromatyczne mogą zastąpić atomy wodoru dowolnym innym podstawnikiem. Osiąga się to za pomocą dwóch typów reakcji organicznych: elektrofilowej substytucji aromatycznej (SEAr) lub nukleofilowej substytucji aromatycznej (SNAr)..
Zapachy
Węglowodory aromatyczne, jak sama nazwa wskazuje, charakteryzują się słodkim lub silnym zapachem. Ta właściwość pozwoliła zasadniczo odróżnić je od węglowodorów gazowych i niektórych parafin woskowych..
Przykłady węglowodorów aromatycznych
Węglowodory aromatyczne, mówiąc ściśle, dotyczą tylko tych, które składają się z węgla i wodoru. Nie powinno być żadnych heteroatomów (O, P, N, S itp.). Dlatego w poniższych przykładach pominięto związki, takie jak pirydyna, furan lub fenol..
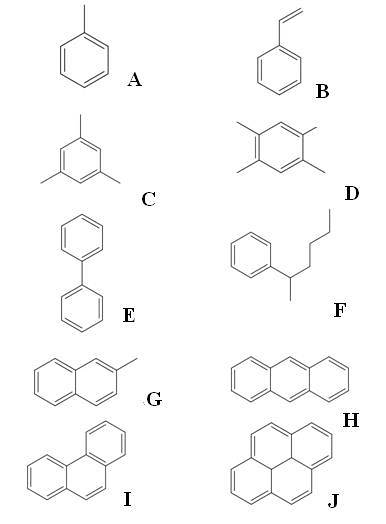
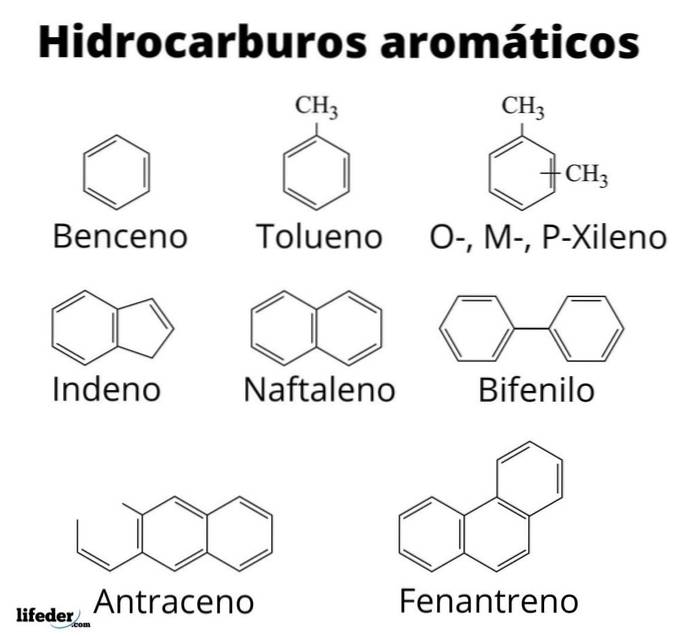
Powyżej mamy dziesięć przykładów węglowodorów aromatycznych. Zauważ, że wszystkie mają co najmniej jeden pierścień benzenowy. Ich imiona to:
A: toluen
B: styren
C: Mesitylen
D: Dureno
E: bifenyl
F: 2-fenyloheksan
G: 2-metylonaftalen
H: antracen
I: Fenantren
J: Pirene
Ze wszystkich o największej wartości przemysłowej ma toluen.
Aplikacje / zastosowania
Większość zastosowań węglowodorów aromatycznych polega na służeniu jako surowiec do syntezy lub wytwarzania produktów o dużej wartości handlowej. Niemal wszystkie wychodzą z benzenu, który poddawany jest różnym reakcjom organicznym w celu uzyskania pochodnych funkcyjnych.
Włókna i tworzywa sztuczne
Cykloheksan jest wytwarzany z benzenu, który następnie przekształca się w inne związki w celu syntezy nylonu 6 lub nylonu 66. Z kolei styren, który składa się z monomeru polistyrenu, można również otrzymać z benzenu. Mamy więc polimery niezbędne do produkcji włókien i tworzyw sztucznych.
Epoksydowa żywica
Z benzenu można również syntetyzować bisfenol A, z którego różnymi drogami syntezy powstają żywice epoksydowe, kleje, kleje, a nawet farby..
Detergenty
Do produkcji detergentów stosuje się alkilobenzeny z długimi łańcuchami bocznymi; w tym alkilobenzenosulfoniany.
TNT
TNT można wytwarzać z toluenu: trinitrotoluenu, jednego z najbardziej znanych materiałów wybuchowych.
Kwas benzoesowy
Z toluenu uzyskuje się kwas benzoesowy jako pochodną, niezbędny związek w formulacjach wielu perfum, leków i żywności..
Rozpuszczalniki
Benzen, toluen i ksylen (BTX) to najczęściej używane rozpuszczalniki organiczne w badaniach ropy naftowej.
Benzyna
Węglowodory aromatyczne wchodzą również w skład benzyny, odgrywając główną rolę w podniesieniu jej liczby oktanowej lub liczby oktanowej..
Bibliografia
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. (10th wydanie.). Wiley plus.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Morrison i Boyd. (1987). Chemia organiczna. (Piąta edycja). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Związek aromatyczny. Odzyskane z: en.wikipedia.org
- Ed Vitz i in. (08 września 2020). Aromatyczne węglowodory. Chemia LibreTexts. Źródło: chem.libretexts.org
- Wyman Elizabeth. (2020). Węglowodory aromatyczne: definicja, przykłady i zastosowania. Nauka. Odzyskany z: study.com
- Boluda, C. J., Macías, M. i González Marrero, J. (2019). Złożoność chemiczna benzyn samochodowych. Nauka, inżynieria i aplikacje,dwa(2), 51-79. Doi: doi.org/10.22206/cyap.2019.v2i2.pp51-79



Jeszcze bez komentarzy