
Wodorotlenek wapnia (Ca (OH) 2) struktura, właściwości, produkcja, zastosowanie

Plik wodorotlenek wapnia jest związkiem nieorganicznym, którego wzór chemiczny to Ca (OH)dwa. Jest to biały proszek używany od tysięcy lat, w którym to czasie zyskał kilka tradycyjnych nazw lub pseudonimów; wśród nich można wymienić wapno gaszone, martwe, chemiczne, hydratyzowane lub miałkie.
W naturze występuje w rzadkim minerale zwanym portlandytem, w tym samym kolorze. Z tego powodu Ca (OH)dwa Nie jest pozyskiwany bezpośrednio z tego minerału, ale w wyniku obróbki cieplnej, a następnie hydratacji wapienia. W ten sposób uzyskuje się wapno CaO, które jest następnie schładzane lub uwadniane w celu wytworzenia Ca (OH)dwa.

Ca (OH)dwa jest stosunkowo słabą zasadą w wodzie, ponieważ trudno ją rozpuszczać w gorącej wodzie; ale jego rozpuszczalność wzrasta w zimnej wodzie, ponieważ jej uwodnienie jest egzotermiczne. Jednak jego zasadowość nadal jest powodem, aby zachować ostrożność podczas obchodzenia się z nim, ponieważ może spowodować oparzenia dowolnej części ciała..
Jest stosowany jako regulator pH różnych materiałów lub żywności, a także jest dobrym źródłem wapnia w odniesieniu do masy. Znajduje zastosowanie w przemyśle papierniczym, w dezynfekcji ścieków, w produktach do depilacji, w artykułach spożywczych z mąki kukurydzianej.
Jednak jego najważniejszym zastosowaniem był materiał konstrukcyjny, ponieważ wapno ulega hydratacji po zmieszaniu z innymi składnikami tynku lub zaprawy. W tych utwardzonych mieszaninach Ca (OH)dwa pochłania dwutlenek węgla z powietrza w celu konsolidacji kryształków piasku wraz z kryształami utworzonymi z węglanu wapnia.
Obecnie nadal prowadzone są badania mające na celu opracowanie lepszych materiałów konstrukcyjnych, które zawierają Ca (OH)dwa bezpośrednio w swoim składzie w postaci nanocząstek.
Indeks artykułów
- 1 Struktura
- 1.1 Kryształ i jego jony
- 1.2 Morfologia
- 2 Właściwości
- 2.1 Wygląd fizyczny
- 2.2 Masa molowa
- 2.3 Temperatura topnienia
- 2.4 Gęstość
- 2,5 pH
- 2.6 Rozpuszczalność w wodzie
- 2,7 Kps
- 2.8 Współczynnik załamania światła
- 2.9 Stabilność
- 3 Otrzymywanie
- 4 Zastosowania
- 4.1 Przetwarzanie żywności
- 4.2 Środek do dezynfekcji ścieków
- 4.3 Przemysł papierniczy
- 4.4 Pochłaniacz gazu
- 4.5 Pielęgnacja osobista
- 4.6 Roboty budowlane
- 5 Zagrożenia i skutki uboczne
- 6 Odnośniki
Struktura
Kryształ i jego jony
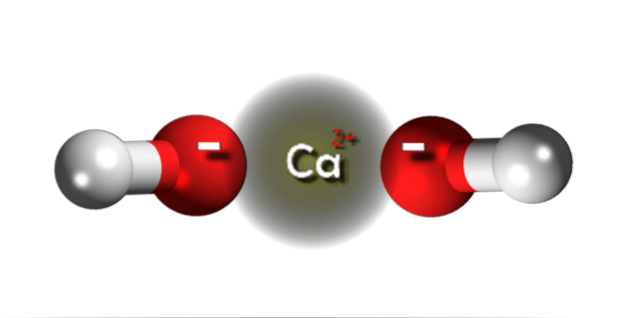
Na górnym obrazku mamy jony tworzące wodorotlenek wapnia. Ten sam wzór Ca (OH)dwa zwraca uwagę, że dla każdego kationu Cadwa+ istnieją dwa aniony OH- które oddziałują z nim poprzez przyciąganie elektrostatyczne. W rezultacie oba jony tworzą kryształ o strukturze heksagonalnej.
W takich sześciokątnych kryształach Ca (OH)dwa jony są bardzo blisko siebie, co sprawia wrażenie struktury polimerowej; chociaż formalnie nie ma wiązania kowalencyjnego Ca-O, biorąc pod uwagę zauważalną różnicę w elektroujemności między dwoma pierwiastkami.
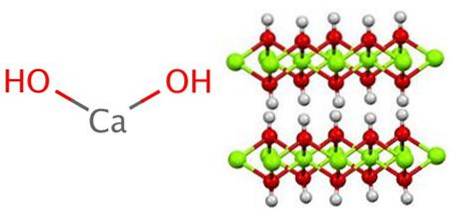
Struktura generuje ośmiościany CaO6, to znaczy Cadwa+ współdziała z sześcioma OH- (ACdwa+-O-).
Szereg tych ośmiościanów tworzy warstwę kryształu, która może oddziaływać z innymi poprzez wiązania wodorowe, które utrzymują ich międzycząsteczkową spójność; jednak ta interakcja zanika w temperaturze 580 ºC, gdy Ca (OH) jest odwodnionydwa do CaO.
Po stronie wysokich ciśnień niewiele jest informacji na ten temat, chociaż badania wykazały, że przy ciśnieniu 6 GPa sześciokątny kryształ przechodzi z fazy heksagonalnej w fazę jednoskośną; a wraz z nim deformacja ośmiościanów CaO6 i jej warstwy.
Morfologia
Kryształy Ca (OH)dwa Są sześciokątne, ale nie stanowi to dla nich przeszkody w przyjęciu jakiejkolwiek morfologii. Niektóre z tych struktur (takie jak pasma, płatki lub skały) są bardziej porowate niż inne, solidne lub płaskie, co bezpośrednio wpływa na ich ostateczne zastosowanie..
Zatem nie jest tym samym stosowanie kryształów z mineralnego portlandytu, co syntetyzowanie ich tak, aby składały się z nanocząstek, w przypadku których przestrzega się kilku rygorystycznych parametrów; takie jak stopień uwodnienia, stężenie użytego CaO i czas wzrostu kryształu.
Nieruchomości
Wygląd fizyczny
Białe, bezwonne, pudrowe ciało stałe o gorzkim smaku.
Masa cząsteczkowa
74,093 g / mol
Temperatura topnienia
580 ° C. W tej temperaturze rozkłada się uwalniając wodę, dzięki czemu nigdy nie ulega odparowaniu:
Ca (OH)dwa => CaO + HdwaLUB
Gęstość
2,211 g / cm3
pH
Jej nasycony wodny roztwór ma pH 12,4 w 25 ° C.
Rozpuszczalność w wodzie
Rozpuszczalność Ca (OH)dwa w wodzie maleje wraz ze wzrostem temperatury. Na przykład w 0 ° C jego rozpuszczalność wynosi 1,89 g / l; podczas gdy przy 20 ºC i 100 ºC wynoszą one odpowiednio 1,73 g / l i 0,66 g / l.
Wskazuje to na fakt termodynamiczny: uwodnienie Ca (OH)dwa jest egzotermiczny, więc zgodnie z zasadą Le Chateliera równanie wyglądałoby tak:
Ca (OH)dwa <=> ACdwa+ + 2OH- + Q
Gdzie Q to uwolnione ciepło. Im cieplejsza woda, tym większa równowaga będzie zmierzać w lewo; to znaczy, mniej Ca (OH) się rozpuścidwa. Z tego powodu w zimnej wodzie rozpuszcza się znacznie bardziej niż we wrzącej wodzie..
Z drugiej strony, wspomniana rozpuszczalność wzrasta, gdy pH staje się kwaśne, z powodu zobojętnienia jonów OH.- i przesunięcie przedniej równowagi w prawo. Podczas tego procesu uwalnia się jeszcze więcej ciepła niż w wodzie obojętnej. Oprócz kwaśnych roztworów wodnych Ca (OH)dwa jest również rozpuszczalny w glicerolu.
K.ps
5,5 10-6. Ta wartość jest uważana za małą i jest zgodna z niską rozpuszczalnością Ca (OH)dwa w wodzie (taki sam bilans jak powyżej).
Współczynnik załamania światła
1,574
Stabilność
Ca (OH)dwa pozostaje stabilny, dopóki nie jest wystawiony na działanie COdwa z powietrza, ponieważ pochłania go i tworzy węglan wapnia, CaCO3. Dlatego zaczyna się zanieczyszczać stałą mieszaniną kryształów Ca (OH)dwa-Złodziej3, gdzie są aniony CO3dwa- konkurowanie z OH- do interakcji z Cadwa+:
Ca (OH)dwa + WSPÓŁdwa => CaCO3 + H.dwaLUB
W rzeczywistości jest to powód, dla którego stężone roztwory Ca (OH)dwa stają się mleczne, gdy pojawia się zawiesina cząstek CaCO3.
Otrzymywanie
Ca (OH)dwa Uzyskuje się go komercyjnie w reakcji wapna CaO z dwu- do trzykrotnym nadmiarem wody:
CaO + H.dwaO => Ca (OH)dwa
Jednak w procesie może wystąpić karbonizacja Ca (OH)dwa, tak jak wyjaśniono powyżej.
Innymi metodami jego uzyskania jest użycie rozpuszczalnych soli wapnia, takich jak CaCldwa lub Ca (NO3)dwa, i zalkalizuj je NaOH, aby wytrącił się Ca (OH)dwa. Kontrolując parametry, takie jak objętość wody, temperatura, pH, rozpuszczalnik, stopień karbonizacji, czas dojrzewania itp., Można zsyntetyzować nanocząstki o różnej morfologii.
Można go również przygotować, wybierając naturalne i odnawialne surowce lub odpady z przemysłu, które są bogate w wapń, których popiół po podgrzaniu i przetworzeniu będzie zawierał wapno; i stąd znowu można przygotować Ca (OH)dwa poprzez uwodnienie tych popiołów bez konieczności marnowania wapienia, CaCO3.
Na przykład, do tego celu wykorzystano agawę, nadając wartość dodaną odpadom z przemysłu tequili..
Aplikacje
Przetwórstwo spożywcze

Wodorotlenek wapnia jest obecny w wielu produktach spożywczych na niektórych etapach ich przygotowania. Na przykład marynaty, takie jak korniszony, zanurza się w ich wodnym roztworze, aby były bardziej chrupiące po zapakowaniu w ocet. Dzieje się tak, ponieważ białka na jego powierzchni absorbują wapń z pożywki..
To samo dzieje się z ziarnami kukurydzy przed przekształceniem ich w mąkę, ponieważ pomaga ona w uwalnianiu witaminy B.3 (niacyna) i ułatwia mielenie. Dostarczany przez nią wapń służy również do dodawania wartości odżywczych niektórym sokom.
Ca (OH)dwa Może również zastąpić proszek do pieczenia w niektórych przepisach na chleb i klarować słodkie roztwory uzyskane z trzciny cukrowej i buraków..
Środek do dezynfekcji ścieków
Oczyszczające działanie Ca (OH)dwa Dzieje się tak, ponieważ działa jako środek flokulujący; to znaczy zwiększa rozmiar zawieszonych cząstek, aż utworzą kłaczki, które później opadną lub można je przefiltrować.
Właściwość ta została wykorzystana do dezynfekcji ścieków, destabilizując jej koloidy, które są nieprzyjemne dla wzroku (i zapachu) widzów..
Przemysł papierniczy
Ca (OH)dwa jest używany w procesie Kraft do regeneracji NaOH używanego do obróbki drewna.
Pochłaniacz gazu
Ca (OH)dwa używany do usuwania COdwa przestrzeni zamkniętych lub w środowiskach, w których ich obecność przynosi efekt przeciwny do zamierzonego.
Higieny osobistej
W preparatach do kremów do depilacji Ca (OH)dwa Jest milcząco znaleziony, ponieważ jego zasadowość pomaga w osłabieniu keratyny włosów, a tym samym łatwiej je usunąć.
Budowa

Ca (OH)dwa Jest obecny od niepamiętnych czasów, integrując masy tynku i zaprawy stosowanej przy budowie egipskich dzieł architektonicznych, takich jak piramidy; także budynki, mauzolea, ściany, schody, posadzki, podpory, a nawet do odbudowy cementu dentystycznego.
Jego działanie wzmacniające wynika z faktu, że podczas „oddychania” COdwa, powstałe kryształy CaCO3 zakończyć w większym stopniu integrując piaski i inne składniki takich mieszanek.
Zagrożenia i skutki uboczne
Ca (OH)dwa Nie jest silnie zasadowym ciałem stałym w porównaniu z innymi wodorotlenkami, chociaż jest bardziej niż Mg (OH)dwa. Mimo to, mimo że nie jest reaktywny ani łatwopalny, jego zasadowość jest nadal wystarczająco agresywna, aby spowodować drobne oparzenia..
Dlatego należy obchodzić się z nim z szacunkiem, ponieważ może podrażniać oczy, język i płuca, a także wywoływać inne dolegliwości, takie jak: utrata wzroku, silna alkalizacja krwi, wysypki skórne, wymioty i ból gardła..
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Wodorotlenek wapnia. Odzyskane z: en.wikipedia.org
- Chávez Guerrero i in. (2016). Synteza i charakterystyka wodorotlenku wapnia otrzymanego z agawy bagassy oraz badanie jego właściwości przeciwbakteryjnych. Odzyskany z: scielo.org.mx
- Riko Iizuka, Takehiko Yagi, Kazuki Komatsu, Hirotada Gotou, Taku Tsuchiya, Keiji Kusaba, Hiroyuki Kagi. (2013). Struktura krystaliczna wysokociśnieniowej fazy wodorotlenku wapnia, portlandytu: badanie dyfrakcji rentgenowskiej proszków in situ i monokryształów. Amerykański mineralog; 98 (8-9): 1421-1428. doi: doi.org/10.2138/am.2013.4386
- Hans Lohninger. (05 czerwca 2019). Wodorotlenek wapnia. Chemia LibreTexts. Źródło: chem.libretexts.org
- Aniruddha S. i in. (2015). Synteza nanowodorotlenku wapnia w środowisku wodnym. Amerykańskie Towarzystwo Ceramiczne. doi.org/10.1111/jace.14023
- Carly Vandergriendt. (12 kwietnia 2018). W jaki sposób stosuje się wodorotlenek wapnia w żywności i czy jest bezpieczny? Odzyskany z: healthline.com
- Brian Clegg. (26 maja 2015). Wodorotlenek wapnia. Źródło: chemistryworld.com


Jeszcze bez komentarzy