
Typy inkretyn i ich budowa, funkcje, mechanizm działania
Plik inkretyna to hormony żołądkowo-jelitowe, które stymulują wydzielanie fizjologicznych stężeń insuliny. Termin ten jest obecnie używany w odniesieniu do dwóch różnych hormonów jelitowych, które mają różne nazwy techniczne: GIP lub „glukozozależny polipeptyd insulinotropowy” oraz GLP-1 lub „peptyd glukagonopodobny 1”.
„Incretin” to słowo i koncepcja ukute w 1932 roku przez belgijskiego fizjologa Jeana La Barre'a, który wprowadził je w celu zdefiniowania jelitowych czynników hormonalnych, które uzupełniały wpływ sekretyny na wydzielanie wydzielane przez trzustkę..
Innymi słowy, La Barre użył terminu inkretyna na określenie dowolnego hormonu jelitowego, który w warunkach fizjologicznych był zdolny do stymulowania lub przyczyniania się do wydzielania hormonów trzustkowych, takich jak insulina, glukagon, polipeptyd trzustkowy (PP) i somatostatyna..
Jednak obecnie termin „inkretyna” jest używany tylko do określenia tych hormonów, które są zdolne do stymulowania zależnej od glukozy trzustkowej syntezy insuliny, w szczególności dwóch peptydów znanych jako GIP i GLP-1. Jednak pojawienie się nowej technologii i głębszych badań endokrynologicznych może ujawnić wiele innych peptydów o podobnej aktywności..
Indeks artykułów
- 1 Rodzaje inkretyn i ich budowa
- 2 Funkcje
- 3 Mechanizm działania
- 3.1 GIP: glukozozależny polipeptyd insulinotropowy
- 3.2 GLP-1: peptyd podobny do glukagonu 1
- 4 Odnośniki
Rodzaje inkretyn i ich budowa
Tradycyjnie u ludzi zdefiniowano tylko dwie inkretyny: insulinotropowy polipeptyd glukozozależny (GIP) i glukagonopodobny peptyd 1 (GLP-1); te dwa hormony działają addytywnie, stymulując wydzielanie insuliny.
Pierwszym z nich, który został wyizolowany, był insulinotropowy polipeptyd glukozozależny (GIP). Glukozozależny polipeptyd insulinotropowy). Jest hormonem peptydowym o długości około 42 aminokwasów i należy do rodziny peptydów glukagon-sekretyna.

Drugim odkrytym inkretyną był peptyd glukagonopodobny 1 (GLP-1). Peptyd podobny do glukagonu-1), który jest produktem ubocznym genu kodującego hormon „proglukagon”; dokładniej mówiąc, część C-końcowego końca białka.
funkcje
Początkowo inkretyny zdefiniowano jako czynniki pochodzące z przewodu pokarmowego, które mają zdolność obniżania poziomu glukozy w osoczu poprzez stymulację wydzielania hormonów trzustkowych, takich jak insulina i glukagon..
Koncepcja ta została utrzymana wraz z pojawieniem się testów radioimmunologicznych, w których potwierdzono stałą komunikację między jelitem a trzustką wewnątrzwydzielniczą..
Wykazano, że doustne podawanie glukozy wiąże się ze znacznym wzrostem poziomu insuliny w osoczu, zwłaszcza w porównaniu z wynikami otrzymanymi po dożylnym podaniu glukozy..
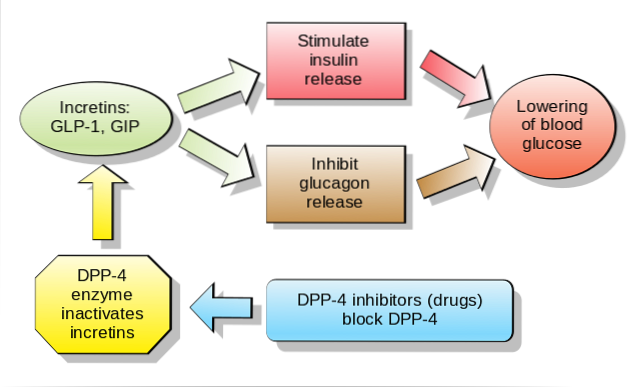
Uważa się, że inkretyny są odpowiedzialne za wydzielanie prawie 70% insuliny w osoczu po doustnym podaniu glukozy, ponieważ są to hormony wydzielane w odpowiedzi na spożycie składników odżywczych, co zwiększa wydzielanie insuliny zależnej od glukozy..
Obecnie podejmuje się wiele wysiłków dotyczących doustnego lub dożylnego podawania inkretyn pacjentom z chorobami, takimi jak cukrzyca typu 2 lub doustna nietolerancja glukozy. Dzieje się tak, ponieważ badania wykazały, choć wstępnie, że substancje te sprzyjają szybkiemu obniżeniu poziomu glikemii po spożyciu pokarmu..
Mechanizm akcji
GIP: glukozozależny polipeptyd insulinotropowy
Ta inkretyna jest wytwarzana przez komórki K jelita cienkiego (szczególnie w dwunastnicy i jelicie czczym) w odpowiedzi na spożycie tłuszczu lub glukozy i jest odpowiedzialna za zwiększenie wydzielania insuliny stymulowanego glukozą..
Ekspresję genu kodującego ten czynnik hormonalny wykazano u ludzi i gryzoni zarówno w żołądku, jak iw jelitach. Badania przeprowadzone z tym hormonem wskazują, że pochodzi on z prekursora „proGIP” o długości 153 aminokwasów, który ma dwa peptydy sygnałowe na końcach N- i C-końcowych, które są rozszczepiane w celu uzyskania aktywnego peptydu o 42 resztach..
Okres półtrwania GIP wynosi mniej niż 7 minut, gdy jest syntetyzowany i przetwarzany enzymatycznie. Peptyd ten jest rozpoznawany przez specyficzny receptor GIPR, który znajduje się w błonie plazmatycznej komórek trzustki, żołądku, jelicie cienkim, tkance tłuszczowej, korze nadnerczy, przysadce mózgowej, serce, płuca i inne główne narządy.
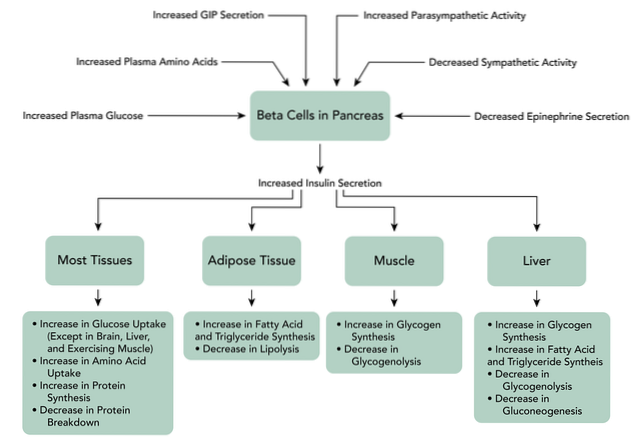
Kiedy GIP wiąże się ze swoimi receptorami na komórkach beta trzustki, powoduje wzrost produkcji cAMP, a także hamowanie zależnych od ATP kanałów potasowych, wzrost wewnątrzkomórkowego wapnia i wreszcie egzocytozę granulek magazynujących insulinę.
Ponadto peptyd ten może stymulować transkrypcję genów i biosyntezę insuliny, a także inne składniki komórek beta trzustki do „spisu” glukozy. Chociaż GIP działa głównie jako hormon inkretynowy, pełni również inne funkcje w innych tkankach, takich jak między innymi ośrodkowy układ nerwowy, kości..
GLP-1: peptyd podobny do glukagonu 1
Ten peptyd jest wytwarzany z genu, który koduje „proglukagon”, więc jest to peptyd, który wykazuje blisko 50% identyczności z sekwencją glukagonu i dlatego jest nazywany peptydem „podobnym do glukagonu”.
GLP-1, posttranslacyjny produkt proteolityczny, jest specyficzny dla tkanki i jest wytwarzany przez komórki L jelita w odpowiedzi na przyjmowanie pokarmu. Podobnie jak GIP, ta inkretyna ma zdolność zwiększania wydzielania insuliny stymulowanego glukozą.
Ekspresja i przetwarzanie genów
Peptyd ten jest kodowany w jednym z eksonów genu proglukagonu, który ulega ekspresji w komórkach alfa trzustki, komórkach L jelita (w dystalnej części jelita krętego) oraz w neuronach pnia mózgu i podwzgórza.
W trzustce ekspresja tego genu jest stymulowana przez post i hipoglikemię (niskie stężenia glukozy we krwi) i jest hamowana przez insulinę. W komórkach jelit ekspresja genu proglukagonu jest aktywowana przez zwiększony poziom cAMP i spożycie pokarmu.
Produkt powstały w wyniku ekspresji tego genu jest potranslacyjnie przetwarzany w komórkach enteroendokrynnych L (w jelicie cienkim), w wyniku czego uwalnia się nie tylko glukagonopodobny peptyd 1, ale także inne mało znane czynniki, takie jak glicentyna, oksyintomodulina, peptyd glukagonopodobny 2 itp..
Produkcja i akcja
Spożycie pokarmów, zwłaszcza bogatych w tłuszcze i węglowodany, stymuluje wydzielanie peptydu GLP-1 z jelitowych komórek enteroendokrynnych L (może również wystąpić stymulacja nerwów lub stymulacja za pośrednictwem wielu innych czynników).
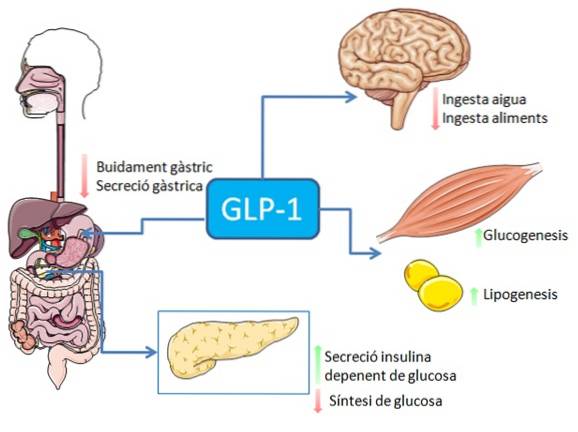
U ludzi i gryzoni peptyd ten jest uwalniany do krwiobiegu w dwóch fazach: 10-15 minut po spożyciu i 30-60 minut później. Aktywny czas życia tego hormonu we krwi wynosi mniej niż 2 minuty, ponieważ jest on szybko proteolitycznie inaktywowany przez enzym dipeptydylopeptydazę-4 (DPP-4).
GLP-1 wiąże się ze specyficznym receptorem błonowym (GLP-1R) na różnych komórkach organizmu, w tym niektórych endokrynnych komórkach trzustki, gdzie stymuluje zależne od glukozy wydzielanie insuliny.
W jaki sposób?
Wiązanie GLP-1 z jego receptorem na komórkach beta trzustki aktywuje w tych komórkach wytwarzanie cAMP za pośrednictwem cyklazy adenylanowej. Występuje bezpośrednie hamowanie zależnych od ATP kanałów potasowych, które depolaryzują błonę komórkową.
Następnie wzrasta wewnątrzkomórkowy poziom wapnia, co jest wynikiem zależnego od GLP-1 napływu zewnątrzkomórkowego wapnia przez zależne od napięcia kanały wapniowe, aktywacji nieselektywnych kanałów kationowych i mobilizacji rezerw wapnia..
Zwiększa również syntezę ATP w mitochondriach, co sprzyja depolaryzacji. Później kanały potasowe bramkowane napięciem są zamykane, co zapobiega repolaryzacji komórek beta i ostatecznie dochodzi do egzocytozy ziarnistości magazynujących insulinę..
W układzie pokarmowym wiązanie GLP-1 z jego receptorami działa hamująco na wydzielanie kwasu żołądkowego i opróżnianie żołądka, co osłabia wzrost stężenia glukozy we krwi związany z przyjmowaniem pokarmu..
Bibliografia
- Baggio, L. L., & Drucker, D. J. (2007). Biologia inkretyn: GLP-1 i GIP. Gastroenterology, 132 (6), 2131-2157.
- Deacon, C. F. i Ahrén, B. (2011). Fizjologia inkretyn w zdrowiu i chorobie. Przegląd badań dotyczących cukrzycy: RDS, 8 (3), 293.
- Grossman, S. (2009). Różnicowanie terapii inkretynowych w oparciu o aktywność struktury i metabolizm: nacisk na liraglutyd. Farmakoterapia: The Journal of Human Pharmacology and Drug Therapy, 29 (12P2), 25S-32S.
- Kim, W. i Egan, J. M. (2008). Rola inkretyn w homeostazie glukozy i leczeniu cukrzycy. Recenzje farmakologiczne, 60 (4), 470-512.
- Nauck, M. A. i Meier, J. J. (2018). Hormony inkretynowe: ich rola w zdrowiu i chorobie. Cukrzyca, otyłość i metabolizm, 20, 5-21.
- Rehfeld, J. F. (2018). Pochodzenie i rozumienie pojęcia inkretyn. Granice endokrynologii, 9.
- Vilsbøll, T. i Holst, J. J. (2004). Inkretyny, wydzielanie insuliny i cukrzyca typu 2. Diabetologia, 47 (3), 357-366


Jeszcze bez komentarzy