
Charakterystyka izobar, przykłady i różnice z izotopami

Plik izobary To te gatunki atomów, które mają tę samą masę, ale pochodzą z różnych pierwiastków chemicznych. W konsekwencji można powiedzieć, że składają się one z różnej liczby protonów i neutronów.
Zarówno protony, jak i neutrony znajdują się w jądrze swoich atomów, ale liczba netto neutronów i protonów obecnych w każdym jądrze pozostaje taka sama. Innymi słowy, gatunek izobarowy powstaje, gdy para jąder atomowych wykazuje taką samą liczbę netto neutronów i protonów dla każdego gatunku..
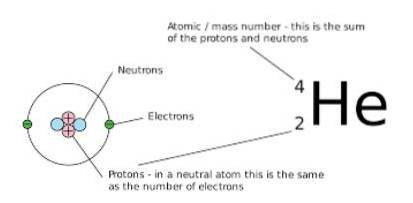
Jednak liczba neutronów i protonów, które składają się na tę ilość netto, jest inna. Jednym ze sposobów, aby to zauważyć graficznie, jest obserwacja liczby masowej (która jest umieszczona w lewym górnym rogu symbolu reprezentowanego pierwiastka chemicznego), ponieważ w izobarach ta liczba jest taka sama.
Indeks artykułów
- 1 Funkcje
- 1.1 Reprezentacja
- 2 Przykłady
- 3 Różnice między izobarami i izotopami
- 4 Odnośniki
Charakterystyka
Po pierwsze, etymologia terminu isobarus pochodzi od greckich słów isos (co oznacza „równy”) i baros (co oznacza „wagę”), co odnosi się do równości mas między obydwoma gatunkami jądrowymi.
Należy zauważyć, że izobary mają pewne podobieństwa z innymi gatunkami, których jądra mają zbiegi okoliczności, takie jak izotony, które mają taką samą liczbę neutronów, ale różne liczby masowe i liczby atomowe, takie jak pary 13C i 14Nie 36S i 37Cl.
Z drugiej strony, termin „nuklid” to nazwa, która została ukuta dla każdego z zestawów nukleonów (struktur składających się z neutronów i protonów), które mogą zostać utworzone.
Tak więc nuklidy można prawdopodobnie rozróżniać na podstawie liczby neutronów lub protonów, a nawet ilości energii posiadanej przez strukturę ich konglomeratu..
Podobnie jądro potomne powstaje po procesie rozpadu β, a to z kolei jest izobarą jądra macierzystego, ponieważ liczba nukleonów obecnych w jądrze pozostaje niezmieniona, w przeciwieństwie do tego, co dzieje się na drodze rozpadu α.
Należy pamiętać, że różne izobary mają różne liczby atomowe, co potwierdza, że są to różne pierwiastki chemiczne..
Reprezentacja
Aby oznaczyć różne nuklidy, stosuje się specjalną notację, którą można przedstawić na dwa sposoby: jeden polega na umieszczeniu nazwy pierwiastka chemicznego i jego liczby masowej, które są połączone myślnikiem. Na przykład: azot-14, którego jądro składa się z siedmiu neutronów i siedmiu protonów.
Innym sposobem przedstawienia tych gatunków jest umieszczenie symbolu pierwiastka chemicznego, poprzedzonego liczbowym indeksem górnym, który wskazuje liczbę masową atomu, o którym mowa, oraz numerycznym indeksem dolnym oznaczającym jego liczbę atomową, w następujący sposób:
ZDOX
W tym wyrażeniu X reprezentuje pierwiastek chemiczny danego atomu, A to liczba masowa (wynik sumowania liczby neutronów i protonów), a Z oznacza liczbę atomową (równą liczbie protonów w jądrze atomu) atom).
Kiedy te nuklidy są reprezentowane, liczba atomowa atomu (Z) jest zwykle pomijana, ponieważ nie dostarcza odpowiednich dodatkowych danych, więc często jest przedstawiana jako DOX.
Jednym ze sposobów pokazania tego zapisu jest skorzystanie z poprzedniego przykładu (azot-14), który jest również oznaczony jako 14N. To jest notacja używana dla izobarów.
Przykłady
Użycie wyrażenia „izobary” w odniesieniu do gatunków znanych jako nuklidy, które mają taką samą liczbę nukleonów (równą liczbę masową), zaproponował pod koniec lat 1910 brytyjski chemik Alfred Walter Stewart..
W tym porządku pomysłów przykład izobarów można zaobserwować w przypadku gatunku 14C i 14N: liczba masowa jest równa 14, co oznacza, że liczba protonów i neutronów w obu gatunkach jest różna.
Rzeczywiście, ten atom węgla ma liczbę atomową równą 6, więc w jego strukturze jest 6 protonów, az kolei jego jądro ma 8 neutronów. Więc jego liczba masowa to 14 (6 + 8 = 14).
Ze swojej strony atom azotu ma liczbę atomową równą 7, czyli składa się z 7 protonów, ale ma też 7 neutronów w swoim jądrze. Jego liczba masowa również wynosi 14 (7 + 7 = 14).
Możesz również znaleźć serię, w której wszystkie atomy mają liczbę masową równą 40; tak jest w przypadku izobarów: 40AC, 40K., 40Ar, 40Cl i 40S.
Różnice między izobarami i izotopami
Jak wyjaśniono wcześniej, nuklidy opisują różne klasy istniejących jąder atomowych w zależności od liczby posiadanych protonów i neutronów..
Wśród tych typów nuklidów znajdują się również izobary i izotopy, które zostaną rozróżnione poniżej.
W przypadku izobarów, jak wspomniano wcześniej, mają one taką samą liczbę nukleonów - czyli taką samą liczbę mas - przy czym liczba protonów, o które jeden gatunek jest większy od drugiego, zgadza się z liczbą neutronów. mają deficyt, więc suma jest taka sama. Jednak jego liczba atomowa jest inna.
W tym sensie gatunki izobarów pochodzą z różnych pierwiastków chemicznych, więc znajdują się w różnych przestrzeniach układu okresowego i mają różne cechy i specyficzne właściwości..
Z drugiej strony w przypadku izotopów dzieje się odwrotnie, ponieważ mają one tę samą liczbę atomową, ale różne masy; to znaczy mają taką samą liczbę protonów, ale inną liczbę neutronów w swoich jądrach atomowych..
Ponadto izotopy są atomami należącymi do tych samych pierwiastków, więc znajdują się w tej samej przestrzeni układu okresowego i mają podobne cechy i właściwości..
Bibliografia
- Wikipedia. (s.f.). Isobar (nuklid). Odzyskany z en.wikipedia.org
- Britannica, E. (s.f.). Izobara. Pobrane z britannica.com
- Konya, J. i Nagy, N. M. (2018). Jądrowa i radiochemia. Odzyskany z books.google.co.ve
- Edukacja energetyczna. (s.f.). Isobar (jądrowa). Pobrane z energyeducation.ca
- Widok nauczyciela. (s.f.). Jądra. Odzyskany z physics.tutorvista.com


Jeszcze bez komentarzy