
Funkcje LDH, oznaczanie, reakcja, wartości normalne
Plik dehydrogenaza mleczanowa, Dehydrogenaza kwasu mlekowego, NAD-zależna dehydrogenaza mleczanowa lub po prostu LDH, to enzym należący do grupy oksydoreduktaz, który występuje praktycznie we wszystkich tkankach zwierzęcych i roślinnych oraz w wielu mikroorganizmach, takich jak bakterie, drożdże i archeony.
Enzymy tego typu są oznaczone numerem EC 1.1.1.27 Komitetu Nomenklatury Enzymów i są odpowiedzialne za reakcję, która przekształca mleczan w pirogronian (przez utlenianie) i odwrotnie (przez redukcję), utleniając lub redukując dinukleotydy nikotynamidoadeninowe (NAD + i NADH) w procesie zwanym fermentacją mlekową.
W przeciwieństwie do fermentacji alkoholowej, która zachodzi tylko w niektórych mikroorganizmach, takich jak drożdże, i która wykorzystuje pirogronian glikolityczny do produkcji etanolu, fermentacja mlekowa zachodzi w wielu organizmach i tkankach różnych organizmów żywych..
Ten ważny enzym metabolizmu komórkowego został wykrystalizowany z mięśni szkieletowych szczurów w latach czterdziestych XX wieku i do chwili obecnej najlepiej scharakteryzowano mięśnie szkieletowe i tkankę sercową ssaków..
U zwierząt „wyższych” enzym wykorzystuje izomer L mleczanu (L-mleczan) do produkcji pirogronianu, ale niektóre „niższe” zwierzęta i bakterie wytwarzają D-mleczan z pirogronianu uzyskanego w wyniku glikolizy..
Dehydrogenaza mleczanowa jest zwykle wyrażana głównie w tkankach lub komórkach w warunkach beztlenowych (przy niskim ukrwieniu), które na przykład u ludzi mogą charakteryzować stany patologiczne, takie jak rak, choroby wątroby lub serca.
Jednak konwersja pirogronianu do mleczanu jest typowa dla mięśni podczas wysiłku i rogówki oka, która jest słabo dotleniona.
Indeks artykułów
- 1 Funkcje
- 2 Charakterystyka i struktura
- 3 Determinacja
- 3.1 Spektrofotometrycznie
- 3.2 metodą immunohistochemiczną
- 3.3 Dlaczego określa się dehydrogenazę mleczanową?
- 4 Reakcja
- 5 Wartości normalne
- 6 Co to znaczy mieć wysokie LDH?
- 7 Referencje
funkcje
Dehydrogenaza mleczanowa pełni wiele funkcji w wielu szlakach metabolicznych. Stanowi centrum delikatnej równowagi między katabolicznymi i anabolicznymi drogami węglowodanowymi.
Podczas glikolizy tlenowej pirogronian (ostatni produkt na szlaku jako taki) może być stosowany jako substrat dla kompleksu enzymatycznego dehydrogenazy pirogronianowej, przez który ulega dekarboksylacji, uwalniając cząsteczki acetylo-CoA, które są wykorzystywane w dalszej części, mówiąc metabolicznie, w cyklu Krebsa.
Z drugiej strony w glikolizie beztlenowej ostatni etap glikolizy wytwarza pirogronian, który jest wykorzystywany przez dehydrogenazę mleczanową do produkcji mleczanu i NAD.+, który przywraca NAD+ który został użyty podczas reakcji katalizowanej przez dehydrogenazę gliceraldehydo-3-fosforanu.
Ponieważ podczas beztlenowej beztlenowej głównym źródłem produkcji energii w postaci ATP jest glikoliza, dehydrogenaza mleczanowa odgrywa fundamentalną rolę w ponownym utlenianiu NADH wytwarzanego na poprzednich etapach szlaku glikolitycznego, niezbędnego do funkcjonowania innych pokrewnych enzymów.
Dehydrogenaza mleczanowa jest również zaangażowana w glikogenezę, która zachodzi w tkankach, które przekształcają mleczan w glikogen, aw niektórych tkankach tlenowych, takich jak serce, mleczan jest paliwem, które jest ponownie utleniane w celu produkcji energii i redukcji mocy w postaci ATP i NAD+, odpowiednio.
Charakterystyka i struktura
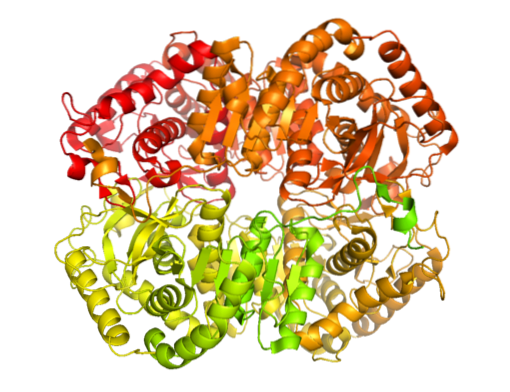
W naturze występuje wiele form molekularnych dehydrogenazy mleczanowej. Tylko u zwierząt stwierdzono, że istnieje pięć aktywności dehydrogenazy mleczanowej, wszystkie tetrameryczne i zasadniczo złożone z dwóch typów łańcuchów polipeptydowych znanych jako podjednostki H i M (mogą być homo- lub heterotetrameryczne).
Forma H jest zwykle znajdowana w tkance serca, podczas gdy forma M została wykryta w mięśniach szkieletowych. Oba łańcuchy różnią się od siebie liczebnością, składem aminokwasów, właściwościami kinetycznymi i właściwościami strukturalnymi..
Formy H i M są produktem translacji różnych genów, prawdopodobnie zlokalizowanych na różnych chromosomach, i które są również pod kontrolą lub regulacją różnych genów. Forma H dominuje w tkankach z metabolizmem tlenowym, a forma M w tkankach beztlenowych..
Inny rodzaj nomenklatury wykorzystuje litery A, B i C dla różnych typów enzymów zarówno u ssaków, jak iu ptaków. Zatem dehydrogenaza mleczanowa mięśni jest znana jako A4, serca jak B.4 a trzeci nazywa się C4, który jest specyficzny dla jąder.
Ekspresja tych izoenzymów jest regulowana zarówno w zależności od rozwoju, jak i tkanki..
Enzym został wyizolowany z różnych źródeł zwierzęcych i ustalono, że jego struktura tetrameryczna ma średnią masę cząsteczkową około 140 kDa i że miejsce wiązania NADH lub NAD+ składa się z arkusza złożonego w β składającego się z sześciu łańcuchów i 4 helis alfa.
Determinacja
Spektrofotometrią
Aktywność dehydrogenazy mleczanowej pochodzenia zwierzęcego określa się spektrofotometrycznie in vitro przez pomiary zmiany koloru w wyniku procesu redoks zachodzącego podczas reakcji konwersji pirogronianu do mleczanu.
Pomiary wykonuje się przy 340nm za pomocą spektrofotometru i określa się szybkość spadku gęstości optycznej w wyniku utleniania lub „zaniku” NADH, który jest konwertowany na NAD.+.
Oznacza to, że określona reakcja jest następująca:
Pirogronian + NADH + H+ → Mleczan + NAD+
Pomiar enzymatyczny należy przeprowadzać w optymalnych warunkach pH i stężenia substratów dla enzymu, aby nie było ryzyka niedoszacowania ilości obecnych w próbkach z powodu niedoboru substratów lub ekstremalnych warunków kwasowości lub zasadowości.
Za pomocą immunohistochemii
Inna, być może nieco nowocześniejsza metoda oznaczania obecności dehydrogenazy mleczanowej polega na zastosowaniu narzędzi immunologicznych, czyli przy użyciu przeciwciał..
Metody te wykorzystują powinowactwo między wiązaniem antygenu z przeciwciałem specyficznie wytworzonym przeciwko niemu i są bardzo przydatne do szybkiego określania obecności lub braku enzymów, takich jak LDH, w określonej tkance..
W zależności od celu, stosowane przeciwciała muszą być specyficzne do wykrywania któregokolwiek z izoenzymów lub dowolnego białka o aktywności dehydrogenazy mleczanowej..
Po co określać dehydrogenazę mleczanową?
Oznaczanie tego enzymu przeprowadza się w różnych celach, ale głównie do diagnostyki klinicznej niektórych schorzeń, w tym zawału mięśnia sercowego i raka..
Na poziomie komórkowym uwolnienie dehydrogenazy mleczanowej uznano za jeden z parametrów określających występowanie procesów nekrotycznych lub apoptotycznych, ponieważ błona plazmatyczna staje się przepuszczalna.
Produkty reakcji, które katalizuje, można również określić w tkance w celu ustalenia, czy z jakiegoś szczególnego powodu przeważa metabolizm beztlenowy..
Reakcja
Jak wspomniano na początku, enzym dehydrogenaza mleczanowa, którego nazwa systematyczna to (S) -mleczan: NAD+ dehydrogenaza, katalizuje przemianę mleczanu do pirogronianu w postaci NAD+ zależne lub odwrotnie, co następuje dzięki przeniesieniu jonu wodorkowego (H.-) z pirogronianu do mleczanu lub z NADH do utlenionego pirogronianu.

NAD+ Zawiera jednostkę ADP i inną grupę nukleotydów pochodzącą z kwasu nikotynowego, zwaną także niacyną lub witaminą B3, i ten koenzym bierze udział w wielu reakcjach o dużym znaczeniu biologicznym.
Należy zauważyć, że równowaga w tej reakcji jest przesunięta w stronę mleczanu i wykazano, że enzym jest również zdolny do utleniania innych kwasów (S) -2-hydroksymonokarboksylowe i wykorzystują, chociaż mniej wydajnie, NADP+ jako podłoże.
W zależności od rozpatrywanego obszaru ciała i jednocześnie od jego właściwości metabolicznych związanych z obecnością lub nieobecnością tlenu, tkanki wytwarzają różne ilości mleczanu, produktu reakcji katalizowanego przez LDH..
Biorąc pod uwagę na przykład czerwoną krwinkę (erytrocyt), której brakuje mitochondriów, które mogą metabolizować pirogronian wytwarzany podczas glikolizy do COdwa i wody, to można by powiedzieć, że są to główne komórki ludzkiego organizmu produkujące mleczan, ponieważ cały pirogronian jest przekształcany w mleczan pod działaniem dehydrogenazy mleczanowej.
Z drugiej strony, jeśli weźmie się pod uwagę komórki wątroby i komórki mięśni szkieletowych, są one odpowiedzialne za produkcję minimalnej ilości mleczanu, ponieważ jest on szybko metabolizowany..
Wartości normalne
Stężenie dehydrogenazy mleczanowej w surowicy krwi jest wynikiem ekspresji kilku izoenzymów między innymi w wątrobie, sercu, mięśniach szkieletowych, erytrocytach i nowotworach..
W surowicy krwi normalne zakresy aktywności dehydrogenazy mleczanowej wynoszą od 260 do 850 U / ml (jednostki na mililitr), przy średniej wartości 470 ± 130 U / ml. Tymczasem hemolizaty krwi mają aktywność LDH, która waha się między 16 000 a 67 000 U / ml, co odpowiada średnio 34 000 ± 12 000 U / ml..
Co to znaczy mieć wysokie LDH?
Oznaczanie ilościowe stężenia dehydrogenazy mleczanowej w surowicy krwi ma istotne znaczenie w diagnostyce niektórych chorób serca, wątroby, krwi, a nawet nowotworów.
Wysokie poziomy aktywności LDH stwierdzono u pacjentów z zawałami mięśnia sercowego (zarówno eksperymentalnymi, jak i klinicznymi), a także u pacjentów z rakiem, szczególnie u kobiet z rakiem trzonu macicy, jajnika, piersi i macicy..
W zależności od konkretnego izozymu znajdującego się w „nadmiarze” lub w wysokim stężeniu, ilościowe oznaczanie izoenzymów dehydrogenazy mleczanowej jest stosowane przez wielu lekarzy do określenia uszkodzenia tkanki (ciężkiego lub przewlekłego)..
Bibliografia
- Bergmeyer, H., Bernt, E. i Hess, B. (1961). Dehydrogenaza mlekowa. Metody analizy enzymatycznej. Verlag Chemie, GmbH.
- Chung, F., Tsujubo, H., Bhattacharyya, U., Sharief, F., & Li, S. (1985). Organizacja genomowa ludzkiego genu dehydrogenazy mleczanowej-A. Biochemical Journal, 231, 537-541.
- De Becker, D. (2003). Kwasica mleczanowa. Intensywna opieka med, 29, 699-702.
- Everse, J. i Kaplan, N. (1973). Dehydrogenazy mleczanowe: struktura i funkcja. W Postępy w enzymologii i pokrewnych dziedzinach biologii molekularnej (s. 61-133).
- Fox, S. I. (2006). Ludzka psychologia (Wyd. 9). Nowy Jork, USA: McGraw-Hill Press.
- Huijgen, H., Sanders, G. T. B., Koster, R. W., Vreeken, J., & Bossuyt, P. M. M. (1997). Wartość kliniczna dehydrogenazy mleczanowej w surowicy: przegląd ilościowy. Eur J Clin Chem Clin Biochem, 35(8), 569-579.
- Komitet ds. Nomenklatury Międzynarodowej Unii Biochemii i Biologii Molekularnej (NC-IUBMB). (2019). Pobrane z www.qmul.ac.uk/sbcs/iubmb/enzyme/index.html
- Rawn, J. D. (1998). Biochemia. Burlington, Massachusetts: Neil Patterson Publishers.
- Usategui-Gomez, M., Wicks, R. W. i Warshaw, M. (1979). Immunochemiczne oznaczanie izoenzymu dehydrogenazy mleczanowej (LDH1) serca w surowicy ludzkiej. Clin Chem, 25(5), 729-734.
- Wróblewski, F. i Ladue, J. S. (1955). Aktywność degydrogenazy mlekowej we krwi. Biologia eksperymentalna i medycyna, 90, 210-215.
Jeszcze bez komentarzy