
Aktualne cechy modeli atomowych, postulaty i wpływowi naukowcy

Plik aktualny model atomowy jest tą, która opiera się na mechanice kwantowej, w szczególności na równaniu Schrödingera, na zasadzie wykluczenia Pauliego i właściwości elektronu zwanej obracać lub obracać.
Jest to najpowszechniej akceptowany i stosowany model w badaniach budowy atomów, cząsteczek i reaktywności chemicznej pierwiastków, ze względu na precyzję przewidywań i względną prostotę..

Model ten jest ewolucją kilku wcześniejszych modeli atomowych, takich jak model Rutherforda i model Bohra-Sommerfelda, uważanych za modele klasyczne lub półklasyczne..
Obecnie istnieją teoretycznie bardziej kompletne modele niż model kwantowo-mechaniczny Schrödingera, taki jak model Diraca-Jordana, który zawiera szczególną teorię względności i jest oparty na równaniu falowym Diraca. W tym równaniu spin, wspomniana na początku właściwość elektronów, pojawia się naturalnie.
Istnieją również modele oparte na kwantowej teorii pola, stosowane w fizyce wysokich energii. Modele te doskonale nadają się do przewidywania tworzenia i anihilacji cząstek elementarnych, co jest celem tej dziedziny fizyki..
Warto wspomnieć, że najbardziej wyrafinowane teorie prowadzą do tych samych wyników, co w przypadku równania Schrödingera, zwłaszcza dla lekkich atomów..
Indeks artykułów
- 1 Charakterystyka obecnego modelu atomowego
- 1.1 Dualizm falowo-cząsteczkowy
- 1.2 Rozmiar atomu
- 2 Postulaty obecnego modelu atomowego
- 3 Naukowcy wpływający na obecny model atomowy
- 4 Ciekawe artykuły
- 5 Referencje
Charakterystyka obecnego modelu atomowego
W obecnym ujęciu atomu, opartym na nierelatywistycznej mechanice kwantowej, koncepcja orbit elektronowych w stylu układów planetarnych nie pasuje.
Jednak najbardziej rozpowszechnionym obrazem atomu jest nadal dodatnie jądro centralne i kilka punktów ujemnego ładunku elektrycznego (elektronów), obracających się po idealnie określonych orbitach wokół centralnego jądra. Ale pomimo swoich korzeni nie odpowiada już obecnemu modelowi atomowemu.
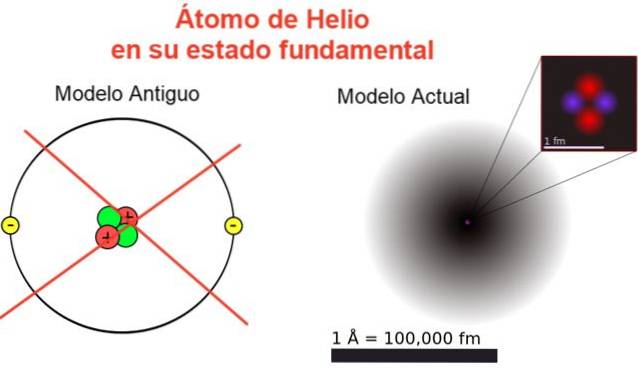
Rysunek 2 przedstawia stary obraz i aktualny obraz atomu helu w jego najniższym stanie energetycznym (poziom n = 1 i l = 0).
Klasyczny obraz jest przydatny, aby zobaczyć, że jądro zawiera dwa protony i dwa neutrony. Gwarantem neutralności atomu są dwa elektrony zajmujące ten sam poziom energii.
Reszta to obraz daleki od rzeczywistości, ponieważ skala jądra nie odpowiada nawet skali atomu: jądro jest 1/100000 razy większe od atomu, ale to właśnie tam koncentruje się masa atomowa.
Dualizm falowo-cząsteczkowy
Mechanika klasyczna ustala, że każda cząstka materialna ma skojarzoną falę, zwaną funkcja falowa. To jest słynny dualizm korpuskularno-falowy użytkownika Louis De Broglie.
W obecnym modelu atomowym zachowanie elektronu w skali atomów jest wyraźnie faliste, podczas gdy na poziomie makroskopowym, podobnie jak elektrony poruszające się w kineskopach starych telewizorów, dominuje zachowanie korpuskularne..
Z drugiej strony, w przypadku fotonów dzieje się odwrotnie, w większości zjawisk optycznych (na poziomie makroskopowym) mają one zasadniczo falowe zachowanie. A kiedy wchodzą w interakcje z atomami materii, zachowują się jak cząsteczki.
Z tego powodu elektrony wokół jądra są rozproszone w obszarach tzw orbitale atomowe, których kształt i zakres będą zależały od poziomu energii elektronów i momentu pędu.
Zarówno energia, jak i moment pędu elektronu wokół jądra mają pewne dozwolone wartości, dlatego mówi się, że są kwantowane.
Równanie falowe Schrödingera przewiduje, jakie wartości energii i momentu pędu są dozwolone, a także funkcję falową związaną z każdym poziomem energii i pędem..
Matematyczny kwadrat funkcji falowej określa orbitale, czyli obszary wokół jądra, w których z większym prawdopodobieństwem można znaleźć elektrony.
Wielkość atomu
Aby uzyskać obraz skali obecnego modelu atomu, wyobraźmy sobie, że atom ma średnicę podobną do wielkości boiska do piłki nożnej. Jądro byłoby jak mrówka w środku pola, ale zdumiewające z 99,9% masy atomowej.
Z drugiej strony elektrony byłyby jak upiorni gracze rozproszeni po całym polu, z większym prawdopodobieństwem znalezienia się w środku pola..
Istnieje kilka ustawień lub dozwolonych sposobów zajmowania pola, które zależą od energii graczy (elektronów) i ilości „spinu” lub obrotu wokół środka..
Postulaty obecnego modelu atomowego
1.- Elektron charakteryzuje się masą m, spinem s a ponieważ jest to cząstka niosąca elementarny ładunek ujemny (-e).
2.- Elektrony zachowują się podwójnie, z jednoczesną falą i cząstką, ale w zależności od ich energii i skali zjawiska, jeden może być bardziej dominujący niż drugi..
3.- Elektrony otaczają dodatnie jądro atomu w taki sposób, że zapewniają elektryczną neutralność atomu. Dlatego liczba elektronów jest równa liczbie protonów; To jest Liczba atomowa, który podaje chemiczne i fizyczne właściwości każdego pierwiastka.
4. - Oddziaływanie między elektronami a jądrem jest modelowane przez potencjał V (r) elektrostatyczny Coulomb, do którego człon energii potencjalnej jest włączony w operator hamiltonianu.
5.- Termin energia kinetyczna w operatorze Hamiltona jest operatorem zbudowanym z liniowego operatora pędu, będąc tym samym:
p = - i ħ ∂ / ∂r
Gdzie ħ jest stałą Plancka podzieloną przez 2π.
6. - Operator Hamiltona H = (p⋅p)/ 2m - e V (r) działa na funkcję fali elektronowej Ψ (r).
7.- Szukając stacjonarnych rozwiązań funkcji fali elektronowej, stosuje się niezależne od czasu równanie Schrödingera:
H Ψ (r) = E Ψ (r)
Gdzie E reprezentuje całkowitą energię elektronu.
8.- W atomach z kilkoma elektronami interakcja między nimi nie jest brana pod uwagę.
9. - Jeśli chodzi o atomy wielu elektronów, orbitale najbardziej zewnętrznych elektronów są modelowane przez potencjał jądra ekranowanego przez najbardziej wewnętrzne elektrony, który jest znany jako potencjał Debye'a.
10.- Równanie (7) ma rozwiązanie dla niektórych dyskretnych wartości energii, tak że słynny planck quanta, wynikają naturalnie z rozwiązań równania Schrödingera.
11.- Dla każdej dyskretnej wartości E istnieje funkcja falowa. Ale niektóre rozwiązania są zdegenerowane, w zależności od wartości momentu pędu L.
12.- Funkcja falowa jest iloczynem funkcji radialnej, azymutalnej i biegunowej.
13.- Ta funkcja falowa określa obszary dozwolone dla elektronu. Kwadratem funkcji falowej jest gęstości prawdopodobieństwa znaleźć elektron w określonej pozycji, patrząc od środka jądra atomowego.
14.- Spin nie pojawia się w równaniu Schrödingera, ale jest włączony do modelu atomowego poprzez zasadę Pauliego:
Elektron jest fermionem z dwoma możliwymi stanami spinowymi + ½ i -½.
Zatem ten sam stan charakteryzowany przez liczby kwantowe n, l, m równania Schrödingera mogą być zajęte przez co najwyżej 2 elektrony o przeciwnych spinach. W ten sposób spin staje się czwartą liczbą kwantową.
Wpływowi naukowcy w obecnym modelu atomowym
Wydaje się to niewiarygodne, ale większość fizyków, którzy przyczynili się do powstania obecnego modelu atomu, pojawia się na tym samym zdjęciu. Poznali się na słynnych konferencjach sponsorowanych przez Ernesta Solvaya, chemika i przemysłowca belgijskiego pochodzenia, który zasłynął w świecie nauki..
Zaczęli się odbywać w 1911 roku i zgromadzili największych ówczesnych naukowców, wśród nich praktycznie wszyscy, którzy wnieśli swój wkład w obecny model atomowy..
Najsłynniejsza z tych konferencji odbyła się w Brukseli w 1927 roku i tam zostało zrobione to historyczne zdjęcie:


- Peter debye
- Irving Langmuir
- Martin Knudsen
- Auguste Piccard
- Max Planck
- William Lawrence Bragg
- Emile Henriot
- Paul Ehrenfest
- Maria Curie
- Hendrik Anthony Kramers
- Edouard Herzen
- Hendrik Antoon Lorentz
- Théophile de Donder
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-Émile Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Urodzony Max
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Brillouin
- Niels Bohr
- Owen Williams Richardson
Ciekawe artykuły
Model atomowy Schrödingera.
Model Atomic de Broglie.
Model atomowy Chadwicka.
Model atomowy Heisenberga.
Model atomowy Perrina.
Model atomowy Thomsona.
Model atomowy Daltona.
Model atomowy Diraca Jordana.
Atomowy model Demokryta.
Model atomowy Leucippus.
Model atomowy Bohra.
Bibliografia
- Alonso - Finn. Podstawy kwantowe i statystyczne. Addison Wesley.
- Bauer, W. 2011. Fizyka dla inżynierii i nauki. Tom 1. Mc Graw Hill.
- Eisberg i Resnick. Fizyka kwantowa. Limusa - Wiley.
- Wikipedia. Teoria atomowa. Odzyskany z: es.wikipedia.com
- Zapata F. Kwantowo-mechaniczny model atomu. Odzyskany z: lifeder.com



Jeszcze bez komentarzy