
Budowa, rodzaje i funkcje białek G.
Plik Białka G. lub białka wiążące nukleotyd guaniny, to białka związane z błoną plazmatyczną należące do rodziny białek „sprzęgających” sygnałowych, które pełnią ważne funkcje w wielu procesach transdukcji sygnału w organizmach eukariotycznych.
W literaturze białka G opisywane są jako binarne przełączniki molekularne, ponieważ ich aktywność biologiczna jest określana przez zmiany w ich strukturze nadane przez gatunki nukleotydów, do których są zdolne do wiązania: nukleotydy guanozyny (difosforan (GDP) i trifosforan (GTP)) ).
Są one generalnie aktywowane przez receptory z rodziny białek zwanych receptorami sprzężonymi z białkiem G (GPCR).Receptory sprzężone z białkiem G "), które otrzymują zewnętrzny sygnał początkowy i przekształcają go w zmiany konformacyjne wyzwalające aktywację, która następnie przekłada się na aktywację innego białka efektorowego.
Niektórzy autorzy uważają, że geny kodujące tę rodzinę białek wyewoluowały w wyniku duplikacji i rozbieżności wspólnego genu przodków, którego produkt był coraz bardziej wyrafinowany i wyspecjalizowany.
Wśród wielu różnorodnych funkcji komórkowych, które pełnią te białka, jest translokacja makrocząsteczek podczas syntezy białek, transdukcja sygnałów hormonalnych i bodźców sensorycznych, a także regulacja proliferacji i różnicowania komórek..
Opisano dwie klasy tego typu białek: małe białka G i heterotrimeryczne białka G. Pierwszą trójwymiarową strukturę białka G uzyskano ponad dziesięć lat temu z małego białka G znanego jako Ras.
Indeks artykułów
- 1 Struktura
- 2 rodzaje
- 2.1 Małe białka G.
- 2.2 Heterotrimeryczne białka G.
- 3 Funkcje
- 3.1 Jak one działają?
- 4 Odnośniki
Struktura
Mówiąc strukturalnie, rozróżnia się dwa typy białek G: małe białka G i znacznie bardziej złożone heterotrimeryczne białka G..
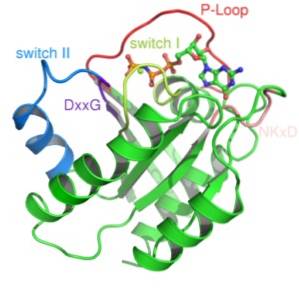
Małe białka G składają się z pojedynczego polipeptydu złożonego z około 200 reszt aminokwasowych i około 20-40 kDa, aw ich strukturze znajduje się konserwowana domena katalityczna (domena G) złożona z pięciu α-helis, sześciu β-fałdowanych arkuszy i pięć pętli polipeptydowych.
Z drugiej strony heterotrimeryczne białka G są integralnymi białkami błonowymi, które składają się z trzech łańcuchów polipeptydowych, znanych jako podjednostki α, β i γ..
-Podjednostka α waży od 40 do 52 kDa, ma region wiążący nukleotyd guaniny i wykazuje aktywność GTPazy do hydrolizowania wiązań między grupami fosforanowymi GTP..
Podjednostki α różnych białek G mają wspólne domeny strukturalne, takie jak te służące do wiązania i hydrolizy GTP, ale mają bardzo różne miejsca wiązania dla białek receptorowych i efektorowych..
-Podjednostka β ma nieco niższą masę cząsteczkową (od 35 do 36 kDa).
-Z drugiej strony podjednostka γ jest znacznie mniejsza i ma przybliżoną masę cząsteczkową 8 kDa..
Wszystkie heterotrimeryczne białka G mają 7 domen transbłonowych i wykazują podobieństwo sekwencji do domen β i γ. Te dwie domeny są ze sobą tak silnie powiązane, że postrzega się je jako pojedynczą jednostkę funkcjonalną..
Rodzaje
Jak wspomniano powyżej, istnieją dwa rodzaje białek G: małe i heterotrimeryczne..
Małe białka G odgrywają rolę we wzroście komórek, wydzielaniu białek i oddziaływaniu wewnątrzkomórkowym pęcherzyków. Ze swojej strony heterotrimeryczne białka G są związane z transdukcją sygnałów z receptorów powierzchniowych, a także działają jako przełączniki, które zmieniają się między dwoma stanami w zależności od związanego z nimi nukleotydu..
Małe białka G.
Białka te nazywane są również małymi GTPazami, małymi białkami wiążącymi GTP lub nadrodziną białek Ras i tworzą niezależną nadrodzinę w ramach dużej klasy hydrolaz GTP o funkcjach regulatorowych..
Białka te są bardzo zróżnicowane i kontrolują wiele procesów komórkowych. Charakteryzują się konserwatywną domeną wiążącą GTP, domeną „G”. Wiązanie tego nukleotydu fosforanowego powoduje ważne zmiany konformacyjne w jego domenie katalitycznej w małych białkach G..
Jego aktywność jest ściśle związana z białkami aktywującymi GTPazę (GAP).Białko aktywujące GTPazę ”) oraz z czynnikami wymiany nukleotydów guaniny (GEF)Czynnik wymiany nukleotydu guaniny ”).
U eukariotów opisano pięć klas lub rodzin małych białek G:
-Ras
-Rho
-Rab
-Sar1 / Arf
-Biegł
Białka Ras i Rho kontrolują ekspresję genów, a białka Rho również modulują reorganizację cytoszkieletu. Białka z grupy Rab i Sar1 / Arf wpływają na transport pęcherzykowy, a białka Ran regulują transport jądrowy i cykl komórkowy..
Heterotrimeryczne białka G.
Ten typ białka zasługuje również na połączenie z dwoma innymi czynnikami białkowymi, dzięki czemu ścieżka sygnalizacji ze środowiska zewnętrznego do wnętrza komórki składa się z trzech elementów w następującej kolejności:
- Plik sprzężone odbiorniki na białka G.
- Plik Białka G.
- Plik białko albo kanały efektorowe
Istnieje duża różnorodność heterotrimerycznych białek G i jest to związane z dużą różnorodnością podjednostek α występujących w naturze, w których tylko 20% sekwencji aminokwasów jest zachowanych.
Zazwyczaj heterotrimeryczne białka G są identyfikowane dzięki różnorodności podjednostki α, głównie na podstawie ich podobieństw funkcjonalnych i sekwencji..
Podjednostki α składają się z czterech rodzin (rodziny Gs, rodziny Gi / o, rodziny Gq i rodziny G12). Każda rodzina składa się z innego „izotypu”, który razem dodaje ponad 15 różnych form podjednostek α..
Rodzina G.s
Ta rodzina zawiera przedstawicieli, którzy również uczestniczą w regulacji w górę białek cyklazy adenylanowej i jest wyrażana w większości typów komórek. Składa się z dwóch członków: Gs i Golf.
Indeks dolny „s " odnosi się do stymulacji (z angielskiego „stymulacja ") i indeks dolny „olf ” odnosi się do „zapachu” (z angielskiego „Węch”). Białka golfowe są szczególnie wyrażane w neuronach czuciowych odpowiedzialnych za węch.
Rodzina G.I / O
To największa i najbardziej zróżnicowana rodzina. Są wyrażane w wielu typach komórek i pośredniczą w zależnym od receptora hamowaniu różnych typów cyklaz adenylowych (indeks dolny „ja " odnosi się do zahamowania).
Białka z podjednostkami α z grupy Go są szczególnie wyrażane w komórkach ośrodkowego układu nerwowego i mają dwa warianty: A i B..
Rodzina G.co
Białka z tej rodziny podjednostek α są odpowiedzialne za regulację fosfolipazy C. Ta rodzina składa się z czterech członków, których podjednostki α ulegają ekspresji przez różne geny. Występują obficie w komórkach wątroby, nerkach i płucach.
Rodzina G.12
Ta rodzina jest powszechnie wyrażana w organizmach i nie wiadomo na pewno, na czym dokładnie polegają procesy komórkowe regulowane przez białka z tymi podjednostkami..
Podjednostki Β i γ
Chociaż różnorodność struktur alfa jest decydująca dla identyfikacji białek heterotrimerycznych, istnieje również duże zróżnicowanie w odniesieniu do pozostałych dwóch podjednostek: beta i gamma..
funkcje
Białka G uczestniczą w „kierowaniu” sygnałów z receptorów na błonie komórkowej do kanałów lub enzymów efektorowych..
Najczęstszym przykładem funkcji tego typu białka jest regulacja enzymu cyklazy adenylanowej, enzymu odpowiedzialnego za syntezę 3 ', 5'-monofosforanu adenozyny lub po prostu cyklicznego AMP, cząsteczki pełniącej ważne funkcje jako drugi posłaniec w wielu znanych procesach komórkowych:
-Selektywna fosforylacja białek o określonych funkcjach
-Transkrypcja genetyczna
-Reorganizacja cytoszkieletu
-Wydzielanie
-Depolaryzacja błony
Pośrednio uczestniczą również w regulacji kaskady sygnalizacyjnej inozytolu (fosfatydyloinozytolu i jego fosforylowanych pochodnych), które odpowiadają za kontrolę procesów zależnych od wapnia, takich jak chemotaksja i wydzielanie czynników rozpuszczalnych..
Wiele kanałów jonowych i białek transportowych jest bezpośrednio kontrolowanych przez białka z rodziny białek G. W ten sam sposób białka te biorą udział w wielu procesach sensorycznych, takich jak między innymi wzrok, węch..
Jak oni pracują?
Tryb interakcji białka G z białkami efektorowymi jest specyficzny dla każdej klasy lub rodziny białek.
W przypadku białek G sprzężonych z receptorami błonowymi (heterotrimeryczne białka G), wiązanie nukleotydu guaniny, takiego jak GDP lub difosforan guanozyny z podjednostką α, powoduje asocjację trzech podjednostek, tworząc kompleks znany jako Gαβγ lub G-GDP, który jest przymocowany do membrany.
Jeśli cząsteczka GDP jest następnie wymieniana na cząsteczkę GTP, podjednostka α przyłączona do GTP dysocjuje od podjednostek β i γ, tworząc oddzielny kompleks znany jako Gα-GTP, który jest zdolny do zmiany aktywności swoich enzymów lub docelowych białek nośnikowych.
Aktywność hydrolityczna tej podjednostki pozwala na przerwanie aktywacji, wymianę GTP na nowy GDP, przejście do nieaktywnej konformacji..
W przypadku braku wzbudzonych receptorów, które łączą się z białkami G, ten proces wymiany GDP na GTP jest bardzo powolny, co oznacza, że heterotrimeryczne białka G wymieniają GDP na GTP tylko w fizjologicznie istotnym tempie, gdy są związane ze swoimi wzbudzonymi receptorami..
Bibliografia
- Gilman, G. (1987). Białka G: przetworniki sygnałów generowanych przez receptory. Roczne przeglądy w biochemii, 56, 615-649.
- Milligan, G. i Kostenis, E. (2006). Heterotrimeryczne białka G: krótka historia. British Journal of Pharmacology, 147, 546-555.
- Offermanns, S. (2003). Białka G jako przetworniki w sygnalizacji transbłonowej. Postęp w biofizyce i biologii molekularnej, 83, 101-130.
- Simon, M., Strathmann, M. P., & Gautam, N. (1991). Różnorodność białek G w transdukcji sygnału. Nauka, 252, 802-808.
- Syrovatkina, V., Alegre, K. O., Dey, R. i Huang, X. (2016). Regulacja, sygnalizacja i fizjologiczne funkcje białek G.. Journal of Molecular Biology, 428(19), 3850-3868.



Jeszcze bez komentarzy