
Uzasadnienie, procedura i zastosowania testu oksydazy
Plik test oksydazy Jest to metoda diagnostyczna wykazująca obecność kompleksu enzymatycznego zwanego oksydazą cytochromową c. System ten indukuje przemianę cytochromu zredukowanego do utlenionego, ponieważ wychwytuje tlen, a ten z kolei działa jako ostatni akceptor elektronów (H+) w łańcuchu oddechowym.
Termin oksydaza jest skrótowym określeniem enzymu oksydazy cytochromowej, znanego również jako oksydaza indofenolowa. W starożytności uważano, że enzymy oksydaza cytochromowa i oksydaza indofenolowa są dwoma różnymi enzymami, ale dziś wiadomo, że są tymi samymi.
Ze swojej strony cytochromy są hemoproteinami zawierającymi żelazo i uzupełniającymi układ oksydazy cytochromowej. Cytochromy mogą się różnić w zależności od gatunku.
Istnieją różne odmiany cytochromów (cytochromy a1, a2, a3 i 0). Niektóre bakterie mogą wytwarzać tylko jedną, a inne do dwóch lub trzech naraz. W tym sensie obecność cytochromu a i a3 jest znana jako oksydaza cytochromu c. Jest to typ cytochromu wykrywany przez test oksydazy..
Rodzaje Neisseria i Pseudomonas zawierają oksydazę cytochromową c. Te rodzaje dają pozytywny wynik testu oksydazy, pomagając odróżnić je odpowiednio od rodzajów Acinetobacter i Stenotrophomonas..
Istnieją również inne rodzaje oksydazododatnie.
Indeks artykułów
- 1 Uzasadnienie
- 1.1 Charakterystyka układu oksydazy cytochromowej c
- 1.2 Zasada testu
- 2 Procedura
- 2.1 Odczynniki
- 2.2 Protokoły
- 3 Użyj
- 4 Kontrola jakości
- 5 Ograniczenia
- 6 Zalecenia
- 7 Referencje
Podstawa
Charakterystyka układu oksydazy cytochromowej c
Układ oksydazy cytochromu c działa następująco: mikroorganizmy oksydazo-dodatnie wykorzystują tlen do generowania energii poprzez oddychanie tlenowe. System ten działa dzięki transportowi elektronów z substancji dawców, takich jak NADH+ w kierunku substancji receptorowych, w tym przypadku tlenu.
Powoduje to produkcję energii (ATP) i wody lub nadtlenku wodoru, w zależności od układu oksydazy cytochromowej, który posiada mikroorganizm..
Dlatego większość bakterii oksydazododatnich jest również dodatnich pod względem katalazy, co jest warunkiem koniecznym do wyeliminowania wytwarzanego nadtlenku wodoru, ponieważ ta substancja jest toksyczna dla bakterii..
Układ oksydazy cytochromowej c występuje w niektórych bakteriach tlenowych, niektórych fakultatywnych beztlenowcach, nielicznych mikroaerofilnych i nie ma ścisłych beztlenowców. To ostatnie jest zrozumiałe, ponieważ bezwzględne beztlenowce nie mogą żyć w obecności tlenu, dlatego brakuje im układu oksydazy cytochromowej..
Zasada testu
W tym teście wykorzystuje substancje, które działają jako sztuczne akceptory elektronów, zastępując naturalne w łańcuchu transportu elektronów..
Stosowane są głównie barwniki, takie jak parafenylenodiamina i indofenol, które działają jako substraty receptorów i sztuczne donory elektronów.
Parafenylenodiamina jest utleniana przez układ oksydazy cytochromowej c. Barwnik w postaci zredukowanej jest bezbarwny, ale w postaci utlenionej jest zabarwiony.
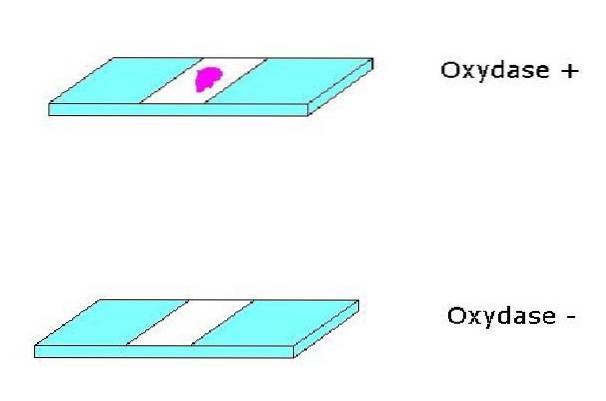
W ten sposób udowadnia się obecność układu oksydazy cytochromowej c; ponieważ pozytywna reakcja spowoduje powstanie lawendowego lub niebiesko-fioletowego koloru, w zależności od użytego odczynnika.
Z drugiej strony, jeśli ostatnia substancja akceptująca elektrony w łańcuchu oddechowym różni się od tlenu, test oksydazy będzie ujemny (nie będzie wytwarzać koloru); tak jest w przypadku mikroorganizmów beztlenowych.
Podobnie, jeśli cytochrom używany przez drobnoustrój różni się od oksydazy cytochromowej c, to również da wynik ujemny..
Proces
Istnieją różne odczynniki i protokoły testu oksydazy, wszystkie w tym samym celu..
Odczynniki
Odczynnik Kovacsa, odczynnik Gordona i McLeoda, odczynnik Nadi, odczynnik Carpentera, Suhrlanda i Morrisona oraz użycie krążków oksydazy.
-Odczynnik oksydazy Kovacsa
Składa się z 1% dichlorowodorku tetrametylo-p-fenylenodiaminy.
Odczynnik Kovacsa przygotowuje się rozpuszczając 1 g wyżej wymienionej substancji w 50 ml wody destylowanej. Jest subtelnie podgrzewany, aż do całkowitego rozpuszczenia. Przenieść do bursztynowej butelki o odpowiedniej pojemności i dopełnić do 100 ml wodą destylowaną. Odczekaj co najmniej 15 minut przed użyciem. Przechowywać w lodówce, chronić przed światłem.
Jest oznaczony odczynnikiem oksydazy Kovacsa, aby odróżnić go od odczynnika Kovacsa używanego do ujawnienia testu indolowego. Ten odczynnik jest najbardziej czuły, mniej toksyczny, ale droższy niż pozostałe odczynniki.
Pozytywna reakcja będzie wykazana w przypadku tego odczynnika ze zmianą koloru kolonii na lawendową, która szybko zmienia kolor na fioletowy, prawie czarny. Negatywna reakcja jest widoczna, ponieważ kolonia nie zmienia koloru lub przybiera lekko różowawe zabarwienie. Pożywka może również ciemnieć, ale nie oznacza to pozytywnej reakcji.
W przypadku tego odczynnika czas reakcji ma kluczowe znaczenie, a zmiana koloru, która występuje między 5 a 15 sekundami, jest uważana za reakcję pozytywną..
-Odczynnik Gordona i McLeoda
Składa się z dichlorowodorku dimetylo-p-fenylenodiaminy, znanego również jako N-dimetylo-p-fenylenodiamina lub monochlorowodorek p-aminodimetyloaniliny. Przygotowuje się go zgodnie z opisem dla odczynnika oksydazy Kovacsa, zastępując substancję, której to dotyczy..
Odczynnik ten jest nieco bardziej stabilny niż odczynnik oksydazy Kovacsa, chociaż wszystkie odczynniki zawierające p-fenylenodiaminę są niestabilne..
Ta reakcja jest później, jest interpretowana jako pozytywna z pojawieniem się niebiesko-fioletowego koloru w ciągu 10 do 30 minut..
-Odczynnik Nadi
Składa się z 1% α-naftolu w alkoholu etylowym (95% etanolu) i 1% aminodimetyloaniliny. Mieszaninę przygotowuje się w równych częściach, używając absolutnego alkoholu etylowego jako rozcieńczalnika, aż do uzupełnienia wystarczającej ilości na 100 ml.
-Odczynnik Carpentera, Suhrlanda i Morrisona
Składa się z 1% szczawianu p-aminodimetyloalaniny. Przygotować w taki sam sposób, jak opisano dla odczynnika oksydazy Kovacsa, zmieniając na odpowiednią substancję.
Po przygotowaniu roztworu przygotować paski testowe w następujący sposób: 6-8 cm paski bibuły filtracyjnej Whatman nr 1 impregnowane 1% odczynnikiem szczawianu dimetylo-p-fenylenodiaminy.
Pozostawia się je do wyschnięcia bez kontaktu z metalem, przechowuje w zakręcanych słoikach ze środkiem osuszającym i przechowuje w lodówce. Te paski są stabilne do 6 miesięcy.
Jest to najbardziej stabilny odczynnik spośród wszystkich wymienionych i może działać do 6 miesięcy w roztworze. Kolejną zaletą jest to, że nie zabarwia podłoża wokół kolonii, jeśli jest stosowany bezpośrednio na płytce.
Pojawienie się koloru czerwonego jest interpretowane jako wynik pozytywny.
-Dyski oksydazy
Są to dostępne w handlu krążki, które są impregnowane odczynnikiem do testu oksydazy. Na rynku jest kilka marek handlowych.
Jego użycie jest dość praktyczne, ponieważ nie ma konieczności przygotowywania świeżych odczynników, co ułatwia pracę. Uzyskane wyniki są wiarygodne, o ile dyski są odpowiednio konserwowane.
Protokoły
Metoda bezpośredniej płytki, metoda pośrednia na papierze oraz użycie krążków impregnowanych odczynnikami oksydazy.
-Metoda bezpośredniej płytki
W tym celu dodaje się 2 lub 3 krople któregokolwiek z wyżej wymienionych odczynników bezpośrednio na kolonię (kolonie) zawartą na płytce pożywki hodowlanej, która nie zawiera glukozy..
Interpretowana jest zmiana lub brak koloru kolonii, a nie pożywka. Właściwy czas reakcji zależy od użytego odczynnika.
-Metoda pośrednia na papierze
Wytnij kawałek bibuły filtracyjnej (Whatman nr 1) do rozmiaru 6 cmdwa i umieszczony w pustej szalce Petriego.
Dodaj 2 lub 3 krople odczynnika oksydazy Kovacsa na papier, weź część kolonii, która ma być badana za pomocą platynowej rączki lub drewnianej wykałaczki i rozprowadź ją w linii prostej na papierze impregnowanym odczynnikiem. Wykonaj w ciągu 5-10 sekund.
Po przygotowaniu pasków z odczynnikiem Carpentera, Suhrlanda i Morrisona na suchy pasek rozprowadza się kolonię. Pojedynczy pasek służy do testowania kilku szczepów. Interpretacja w 10 sek.
-Dyski (mmetoda bezpośrednia)
Delikatnie zwilżyć dostępne w handlu krążki sterylną wodą destylowaną i nałożyć na badaną kolonię. Zaleca się używanie płytek w temperaturze 35 ° C, jeśli używane są płytki w temperaturze pokojowej lub płytki chłodzone, reakcja przebiega nieco wolniej. Zinterpretuj zmianę koloru między 10 a 20 sekund.
Można zastosować kolonie zawarte w agarze z krwią lub czekoladą.
-Dyski (metoda pośrednia)
Zwilżyć dysk zgodnie z wcześniejszym opisem. Umieść go na pustej szalce Petriego. Pobrać wystarczającą ilość kolonii do badania platynową rączką lub drewnianą wykałaczką i umieścić na dysku. Zinterpretuj zmianę koloru między 10 a 20 sekund.
Posługiwać się
Rodzaj Neisseria i Acinetobacter są czasami bardzo podobne pod względem morfologicznym, ponieważ chociaż rodzaj Acinetobacter jest pałeczką Gram-ujemną, może czasami przybierać postać kokkoidy i być rozprowadzana parami, naśladując rodzaj Neisseria..
W tym przypadku test oksydazy jest naprawdę przydatny. Rodzaj Neisseria jest pozytywny, a Acinetobacter negatywny.
Jednak rodzaj Moraxella jest bardzo podobny do rodzaju Neisseria i oba dają pozytywną reakcję; dlatego w celu ostatecznej identyfikacji należy zawsze przeprowadzić testy fermentacji węglowodanów.
Z drugiej strony, test oksydazy jest przydatny do różnicowania bakterii należącej do rodziny Enterobacteriaceae (wszystkie oksydazy ujemne) od innych fermentatorów, takich jak rodzaj Pasteurella, Aeromonas, Plesiomonas (oksydazododatnia).
Rodzaje Vibrio i Helicobacter są również oksydazo-dodatnie.
QA
Użyj znanych szczepów Escherichia coli jako kontrola negatywna i szczepy Pseudomonas aeruginosa jako kontrola pozytywna.
Ograniczenia
-Odczynniki muszą być używane świeżo przygotowane, ich okres przechowywania w roztworze w temperaturze pokojowej jest krótki, ponieważ są bardzo niestabilne. W lodówce mogą trwać od 5 dni do 2 tygodni.
-Odczynniki są bezbarwne, jeśli zmieniają kolor, należy je wyrzucić. Uszkodzone dyski są ewidentne, ponieważ z czasem ciemnieją.
-Pozytywna reakcja z odczynnikiem oksydazy Kovacsa między 15 a 60 sekundami jest uważana za reakcję opóźnioną, a po 60 sekundach powinna być uważana za negatywną.
-Plik Haemophylus influenzae daje ujemną reakcję oksydazy, jeśli używany jest jakikolwiek odczynnik z dimetylo-p-fenylenodiaminą, ale dodatnią, jeśli używany jest odczynnik oksydazy Kovacsa (tetrametylo-p-fenylenodiamina).
-Pożywki zawierające glukozę zakłócają test, dając fałszywie ujemne wyniki.
-Szczepy Bordetella pertussis mogą dawać fałszywie dodatnią reakcję, jeśli pochodzą z wysoko stężonych płytek agarowych z krwią.
-Użycie metalowych (żelaznych) uchwytów daje fałszywie dodatnią reakcję.
zalecenia
-Ponieważ odczynniki są bardzo niestabilne i mają tendencję do samoutleniania, zaleca się zamrażanie podwielokrotności od 1 do 2 ml i wyjmowanie w razie potrzeby..
-Innym sposobem na opóźnienie samoutleniania odczynnika jest dodanie 0,1% kwasu askorbinowego podczas przygotowywania odczynników..
-Ponieważ odczynniki są niestabilne, zaleca się cotygodniową kontrolę jakości..
-Nie należy używać odczynników, które nie przejdą testu kontroli jakości..
Bibliografia
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnoza mikrobiologiczna. 5th ed. Od redakcji Panamericana S.A. Argentyna.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnoza mikrobiologiczna Bailey & Scott. 12 ed. Od redakcji Panamericana S.A. Argentyna.
- „Test oksydazy”. Wikipedia, wolna encyklopedia. 15 stycznia 2018 r., 10:32 UTC. 3 kwietnia 2019, 14:03
- Światowa Organizacja Zdrowia. Laboratory Manual for the Identification and Antimicrobial Susceptibility Testing of Bacterial Pathogens of Public Health Znaczenie in the Developing World.2004. Dostępne pod adresem: who.int/drugresistance/infosharing
- Paski testowe do diagnostyki aktywności oksydazy u bakterii. Rev Cubana Med Trop [Internet]. 2000; 52 (2): 150-151.

Jeszcze bez komentarzy