
Co to są siły dipolowe dipolowe?
Plik siły dipolowe dipolowe lub Siły Keesoma to interakcje międzycząsteczkowe obecne w cząsteczkach z trwałymi momentami dipolowymi. Jest to jedna z sił Van der Waalsa i chociaż nie jest najsilniejsza, jest kluczowym czynnikiem wyjaśniającym właściwości fizyczne wielu związków..
Termin „dipol” wyraźnie odnosi się do dwóch biegunów: jednego ujemnego i jednego dodatniego. Tak więc mówimy o cząsteczkach dipolarnych, gdy mają one zdefiniowane obszary o wysokiej i niskiej gęstości elektronów, co jest możliwe tylko wtedy, gdy elektrony „migrują” preferencyjnie do pewnych atomów: najbardziej elektroujemnych..
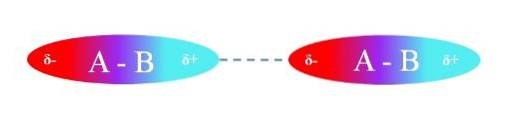
Górny obraz ilustruje oddziaływania dipol-dipol między dwiema cząsteczkami A-B ze stałymi momentami dipolowymi. Podobnie można zaobserwować, w jaki sposób cząsteczki są zorientowane, aby interakcje były wydajne. Zatem dodatni region δ + przyciąga ujemny region δ-.
Zgodnie z powyższym można określić, że tego typu oddziaływania są kierunkowe (w przeciwieństwie do jonowych oddziaływań ładunek-ładunek). Cząsteczki w ich środowisku orientują swoje bieguny w taki sposób, że chociaż są słabe, suma wszystkich tych oddziaływań daje związkowi dużą stabilność międzycząsteczkową..
Powoduje to, że związki (organiczne lub nieorganiczne) zdolne do tworzenia oddziaływań dipol-dipol wykazują wysokie temperatury wrzenia lub topnienia..
Indeks artykułów
- 1 Moment dipolowy
- 1.1 Symetria
- 1.2 Asymetria w cząsteczkach nieliniowych
- 2 Orientacje dipoli
- 3 Oddziaływania wiązaniami wodorowymi
- 4 Odnośniki
Moment dipolowy
Moment dipolowy µ cząsteczki jest wielkością wektorową. Innymi słowy: zależy to od kierunków, w których występuje gradient polaryzacji. Jak i dlaczego powstaje ten gradient? Odpowiedź leży w wiązaniach i wewnętrznej naturze atomów pierwiastków..
Na przykład na górnym obrazie A jest bardziej elektroujemny niż B, więc w wiązaniu A-B najwyższa gęstość elektronów znajduje się wokół A.
Z drugiej strony B „oddaje” swój obłok elektronów i dlatego jest otoczony regionem ubogim w elektrony. Ta różnica w elektroujemności między A i B tworzy gradient biegunowości.
Ponieważ jeden region jest bogaty w elektrony (δ-), podczas gdy drugi jest ubogi w elektrony (δ +), pojawiają się dwa bieguny, które w zależności od odległości między nimi mają różną wielkość µ, która jest określana dla każdego związku.
Symetria
Jeśli cząsteczka pewnego związku ma µ = 0, mówi się, że jest to cząsteczka niepolarna (nawet jeśli ma gradienty polarności).
Aby zrozumieć, jak symetria - a zatem geometria molekularna - odgrywa ważną rolę w tym parametrze, konieczne jest ponowne rozważenie wiązania A-B..
Ze względu na różnicę w ich elektroujemności istnieją określone regiony bogate i ubogie w elektrony.
A co by było, gdyby linki były A-A lub B-B? W tych cząsteczkach nie byłoby momentu dipolowego, ponieważ oba atomy przyciągają do siebie w ten sam sposób elektrony wiązania (stuprocentowe wiązanie kowalencyjne).
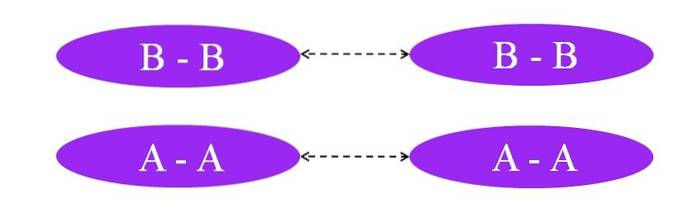
Jak widać na obrazie, ani w cząsteczce A-A, ani w cząsteczce B-B nie ma obecnie regionów bogatych lub ubogich w elektrony (czerwony i niebieski). Tutaj inny rodzaj siły jest odpowiedzialny za trzymanie razem Adwa oraz bdwa: indukowane oddziaływania dipol-dipol, znane również jako siły Londynu lub siły rozpraszania.
Wręcz przeciwnie, gdyby cząsteczki były typu AOA lub BOB, wystąpiłyby odpychanie między ich biegunami, ponieważ mają równe ładunki:
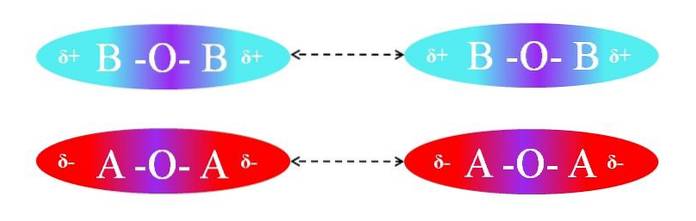
Regiony δ + dwóch cząsteczek BOB nie pozwalają na wydajną interakcję dipol-dipol; to samo dotyczy regionów δ- dwóch cząsteczek AOA. Podobnie obie pary cząsteczek mają µ = 0. Gradient polaryzacji O-A jest wektorowo znoszony z gradientem wiązania A-O.
W konsekwencji siły dyspersji mają również znaczenie w parze AOA i BOB, ze względu na brak skutecznej orientacji dipoli..
Asymetria w cząsteczkach nieliniowych
Najprostszym przypadkiem jest cząsteczka CF4 (lub wpisz CX4). Tutaj C ma tetraedryczną geometrię molekularną, a bogate w elektrony regiony znajdują się na wierzchołkach, szczególnie na elektroujemnych atomach F.
Gradient polaryzacji C-F anuluje się w dowolnym kierunku czworościanu, powodując, że suma wektorów wszystkich tych jest równa 0.
Tak więc, chociaż środek czworościanu jest bardzo dodatni (δ +), a jego wierzchołki bardzo ujemne (δ-), ta cząsteczka nie może tworzyć interakcji dipol-dipol z innymi cząsteczkami..
Orientacje dipoli
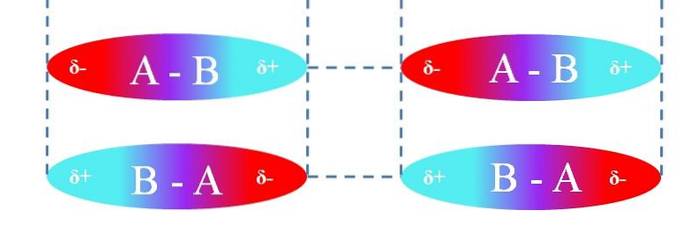
W przypadku liniowych cząsteczek A-B są one zorientowane w taki sposób, że tworzą najbardziej efektywne oddziaływania dipol-dipol (co widać na powyższym obrazku). Powyższe ma zastosowanie w ten sam sposób do innych geometrii molekularnych; na przykład kątowe w przypadku cząsteczek NOdwa.
Zatem te interakcje określają, czy związek A-B jest gazem, cieczą czy ciałem stałym w temperaturze pokojowej..
W przypadku związków Adwa oraz bdwa (te z fioletowych elips), jest bardzo prawdopodobne, że są one gazowe. Jeśli jednak jego atomy są bardzo masywne i łatwo ulegają polaryzacji (co zwiększa siły Londynu), wówczas oba związki mogą być stałe lub ciekłe..
Im silniejsze oddziaływania dipol-dipol, tym większa spójność między cząsteczkami; podobnie, im wyższa temperatura topnienia i wrzenia związku. Dzieje się tak, ponieważ do „przerwania” tych interakcji potrzebne są wyższe temperatury..
Z drugiej strony wzrost temperatury powoduje, że cząsteczki częściej wibrują, obracają się i poruszają. To „mieszanie molekularne” osłabia orientację dipoli, a zatem osłabia siły międzycząsteczkowe związku..
Oddziaływania wiązań wodorowych
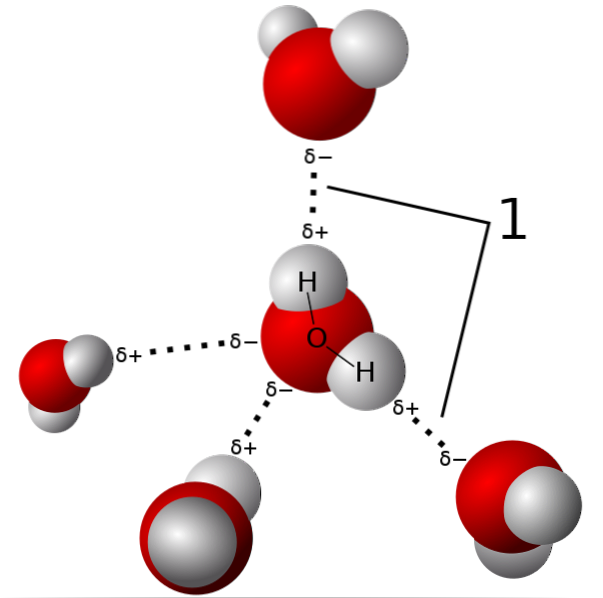
Na powyższym obrazku pokazano pięć cząsteczek wody oddziałujących za pomocą wiązań wodorowych. Jest to szczególny rodzaj oddziaływań dipol-dipol. Region ubogi w elektrony jest zajęty przez H; a region bogaty w elektrony (δ-) jest zajęty przez silnie elektroujemne atomy N, O i F.
Oznacza to, że cząsteczki z atomami N, O i F związanymi z H mogą tworzyć wiązania wodorowe..
Zatem wiązania wodorowe to O-H-O, N-H-N i F-H-F, O-H-N, N-H-O itp. Cząsteczki te mają trwałe i bardzo intensywne momenty dipolowe, które odpowiednio je orientują, aby „wykorzystać” te mostki..
Są energetycznie słabsze niż jakiekolwiek wiązanie kowalencyjne lub jonowe. Aczkolwiek suma wszystkich wiązań wodorowych w fazie związku (stałej, ciekłej lub gazowej) sprawia, że wykazuje on właściwości, które definiują go jako unikatowy..
Na przykład tak jest w przypadku wody, której wiązania wodorowe są odpowiedzialne za jej wysoką temperaturę wrzenia i mniejszą gęstość w stanie lodowym niż woda w stanie ciekłym; powód, dla którego góry lodowe unoszą się na morzach.
Bibliografia
- Siły dipolowo-dipolowe. Pobrane 30 maja 2018 z: chem.purdue.edu
- Bezgraniczna nauka. Siła dipolowo-dipolowa. Pobrane 30 maja 2018 r. Z: course.lumenlearning.com
- Jennifer Roushar. (2016). Siły dipolowo-dipolowe. Pobrane 30 maja 2018 r. Z: sophia.org
- Helmenstine, dr Anne Marie (03 maja 2018). Jakie są przykłady wiązań wodorowych? Pobrane 30 maja 2018 r.Z: thinkco.com
- Mathews, C. K., Van Holde, K.E. i Ahern, K.G. (2002) Biochemistry. Trzecia edycja. Addison Wesley Longman, Inc., str. 33.
- Whitten, Davis, Peck & Stanley. Chemia. (8th ed.). CENGAGE Learning, s. 450–452.
- Użytkownik Qwerter. (16 kwietnia 2011). Model 3D wiązań wodorowych w toalecie. [Postać]. Pobrane 30 maja 2018 z: commons.wikimedia.org


Jeszcze bez komentarzy