
Reakcje pojedynczego i podwójnego przemieszczenia i przykłady
Plik reakcje wypierania to wszystkie, w których jeden rodzaj chemiczny wypiera inny w ramach związku. Przemieszczenie to może być proste lub podwójne, różniąc się tym, że w pierwszym jest to element, który jest przemieszczany, podczas gdy w drugim następuje zmiana „par” między dwoma związkami..
Tego typu reakcje są możliwe tylko w określonych warunkach: jeden z gatunków musi mieć stopień utlenienia równy zero lub wszystkie muszą być koniecznie zjonizowane. Co oznacza zerowa liczba utleniania? Oznacza to, że gatunek jest w stanie naturalnym.

Bardzo ilustracyjnym przykładem powyższego podejścia jest reakcja pomiędzy drutem miedzianym a roztworem azotanu srebra. Ponieważ miedź jest metalem w stanie naturalnym, jej stopień utlenienia wynosi zero; z drugiej strony srebro to +1 (Ag+), który jest rozpuszczony razem z jonami azotanowymi (NO3-).
Metale oddają elektrony, ale niektóre są bardziej aktywne niż inne; Oznacza to, że nie wszystkie metale tak łatwo rdzewieją. Ponieważ miedź jest bardziej aktywna niż srebro, przekazuje swoje elektrony, redukując je do stanu naturalnego, odzwierciedlonego jako srebrna powierzchnia pokrywająca drut miedziany (obrazek powyżej).
Indeks artykułów
- 1 Reakcje przemieszczenia
- 1.1 Proste
- 1.2 Podwójna
- 2 Przykłady
- 2.1 Proste
- 2.2 Podwójne
- 3 Odnośniki
Reakcje przemieszczenia
Prosty
Wypieranie wodoru i metali
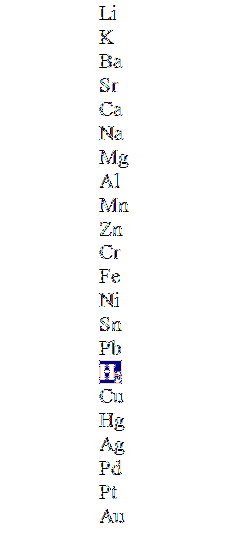
Górny obraz przedstawia kolumnę w malejącej kolejności aktywności, podświetlającą cząsteczkę wodoru. Te metale, które są powyżej tego, mogą go wyprzeć w nieutleniających kwasach (HCl, HF, Hdwapołudniowy zachód4, itp.), a te poniżej w ogóle nie zareagują.
Prostą reakcję przemieszczenia można opisać następującym ogólnym równaniem:
A + BC => AB + C
A wypiera C, który może być cząsteczką H.dwa lub inny metal. tak hdwa powstaje w wyniku redukcji jonów H.+ (2 godz+ + 2e- => H.dwa), to gatunek A musi - ze względu na zachowanie masy i energii - dostarczyć elektronów: musi zostać utleniony.
Z drugiej strony, jeśli A i C są metalami, ale C jest w formie jonowej (M+) i A w stanie naturalnym, to reakcja przemieszczenia zajdzie tylko wtedy, gdy A jest bardziej aktywny niż C, zmuszając to ostatnie do przyjęcia elektronów w celu zredukowania ich do stanu metalicznego (M).
Przemieszczenie z halogenami
W ten sam sposób halogeny (F, Cl, Br, I, At) mogą poruszać się ze sobą, ale w następstwie innej serii czynności. W tym przypadku aktywność maleje, gdy schodzi się do grupy 7A (lub 17): I. Na przykład następująca reakcja zachodzi naturalnie: fadwa(g) + 2NaI (ac) => 2NaF (ac) + Idwa(s) Jednak ta druga nie produkuje żadnych produktów z powodów właśnie wyjaśnionych: jadwa(s) + NaF (ac) => X W powyższym równaniu X oznacza brak reakcji. Dzięki tej wiedzy można przewidzieć, która mieszanina soli halogenowych z czystymi pierwiastkami daje produkty. Z reguły jod (lotna fioletowa substancja stała) nie wypiera żadnego z innych halogenów, ale inne wypierają go, gdy jest w formie jonowej (Na+ ja-). Reakcja podwójnego wypierania, znana również jako reakcja metatezy, jest przedstawiona w następujący sposób: AB + CD => AD + CB Tym razem nie tylko A wypiera C, ale również B wypiera D. Ten rodzaj wypierania występuje tylko wtedy, gdy zmieszają się roztwory rozpuszczalnych soli i tworzy się osad; tj. AD lub CB muszą być nierozpuszczalne i mieć silne oddziaływania elektrostatyczne. Na przykład podczas mieszania roztworów KBr i AgNO3, cztery jony przechodzą przez ośrodek, aż utworzą odpowiednie pary równania: KBr (ac) + AgNO3(ac) => AgBr (s) + KNO3(ac) Jony Ag+ i br- tworzą osad bromku srebra, podczas gdy K+ i nie3- nie może tworzyć kryształu azotanu potasu. Kiedy kwas jest neutralizowany zasadą, zachodzi reakcja podwójnego wypierania: HCl (aq) + NaOH (aq) => NaCl (aq) + HdwaO (l) Tutaj nie tworzy się osad, ponieważ chlorek sodu jest solą bardzo dobrze rozpuszczalną w wodzie, ale następuje zmiana pH, która dostosowuje się do wartości bliskiej 7. Jednak w następującej reakcji jednocześnie następuje zmiana pH i tworzenie się osadu: H.3PO4(ac) + 3Ca (OH)dwa => Ca3(PO4)dwa(s) + 3HdwaO (l) Fosforan wapnia jest nierozpuszczalny, wytrąca się w postaci białej substancji stałej, podczas gdy kwas fosforowy jest neutralizowany wodorotlenkiem wapnia. Cu (s) + 2Ag NO3(ac) => Cu (NO3)dwa(ac) + 2Ag (s) To jest reakcja obrazu na drut miedziany. Jeśli przyjrzysz się serii chemicznej aktywności metali, zauważysz, że miedź znajduje się ponad srebrem, więc może ją wyprzeć. Zn (s) + CuSO4(ac) => ZnSO4(ac) + Cu (s) W przypadku tej drugiej reakcji zachodzi odwrotnie: teraz niebieskawy roztwór CuSO4 staje się przezroczysty, gdy miedź wytrąca się jako metal, a jednocześnie metaliczny cynk rozpada się na rozpuszczalną sól siarczanu cynku. 2Al (s) + 3NiBrdwa(ac) => 2AlBr3(ac) + 3Ni (s) Ponownie, ta reakcja zachodzi, ponieważ glin znajduje się powyżej niklu w szeregu czynności chemicznych. Sn (s) + H.dwapołudniowy zachód4(ac) => SnSO4(ac) + Hdwa(sol) Tutaj cyna wypiera wodór, chociaż w serii jest jej bardzo bliska. 2K (s) + 2HdwaO (l) => 2KOH (aq) + Hdwa(sol) Wreszcie te metale, które są w najwyższej części serii, są tak reaktywne, że wypierają nawet wodór w cząsteczkach wody, generując bardzo egzotermiczną (i wybuchową) reakcję.. Zn (NO3)dwa(aq) + 2NaOH (aq) => Zn (OH)dwa(s) + 2NaNO3(ac) Chociaż baza nie neutralizuje kwasów, to jony OH- czuć większe powinowactwo do Zndwa+ że jony NIE są3-; z tego powodu następuje podwójne przemieszczenie. Znaczek3)dwa(ac) + NadwaS (ac) => CuS (s) + 2NaNO3(ac) Ta reakcja jest bardzo podobna do poprzedniej, z tą różnicą, że oba związki są solami rozpuszczonymi w wodzie..Podwójnie
Reakcja neutralizacji kwasowo-zasadowa
Przykłady
Prosty
Podwójnie
Bibliografia



Jeszcze bez komentarzy