
Charakterystyka, budowa, funkcje receptorów insulinowych
Plik receptory insuliny Są to struktury białkowe odsłonięte po zewnątrzkomórkowej stronie błony plazmatycznej wielu komórek ciała ludzkiego i innych ssaków. Naturalnym ligandem tego receptora jest insulina.
Insulina to hormon syntetyzowany przez komórki ß wysepek Langerhansa endokrynnej części trzustki, narządu zlokalizowanego w jamie brzusznej, który syntetyzuje enzymy trawienne i hormony.
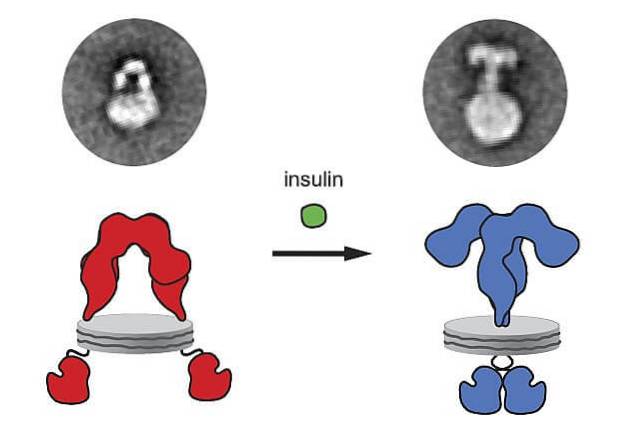
Insulina syntetyzowana i uwalniana przez trzustkę wiąże się ze swoim receptorem na błonie plazmatycznej komórek docelowych iw konsekwencji tego wiązania ligand-receptor wyzwalany jest szereg procesów wewnątrzkomórkowych, które ostatecznie sprzyjają wejściu glukozy do tych komórek..
Insulina jest odpowiedzialna za aktywację wielu reakcji anabolicznych lub syntetycznych związanych z metabolizmem węglowodanów, tłuszczów i białek..
Receptory insuliny są glikoproteinami utworzonymi przez cztery podjednostki z ich aminowymi i karboksylowymi częściami końcowymi w regionie cytoplazmatycznym. Kiedy te receptory wiążą się z insuliną, zlepiają się ze sobą i tworzą endocyt.
W otyłości i cukrzycy typu II liczba receptorów insuliny jest zmniejszona, co częściowo wyjaśnia oporność na insulinę, która towarzyszy tym stanom patologicznym.
Indeks artykułów
- 1 Funkcje
- 2 Struktura
- 3 Funkcje
- 4 Choroby
- 5 Referencje
Charakterystyka
Receptory insuliny są częścią rodziny receptorów błonowych, które mają miejsca wiązania dla hormonów o charakterze białkowym. Ten rodzaj hormonów nie może przenikać przez błony komórkowe, więc ich działanie metaboliczne odbywa się za pośrednictwem ich receptorów..
Insulina to hormon peptydowy związany z promowaniem syntetycznych reakcji zwanych łącznie reakcjami anabolicznymi, które są związane z metabolizmem węglowodanów, tłuszczów i białek..
Wiele komórek ma receptory insuliny, głównie komórki mięśniowe, komórki wątroby i komórki tkanki tłuszczowej. Jednak inne komórki, które najwyraźniej nie są komórkami docelowymi insuliny, również posiadają receptory insuliny..
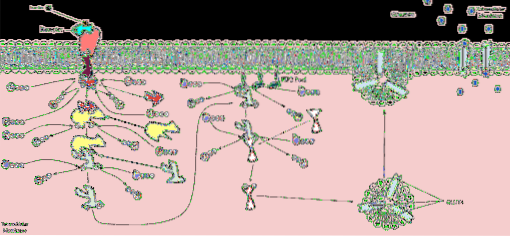
Wnikanie glukozy do komórek, w niektórych tkankach, jest zależne od insuliny, ponieważ w nich białka odpowiedzialne za ułatwioną dyfuzję glukozy znajdują się w małych kawałkach błony tworzących pęcherzyki wewnątrzkomórkowe.
Kiedy insulina wiąże się ze swoim receptorem w tego typu komórkach insulinozależnych, transportery glukozy zlokalizowane w pęcherzykach wewnątrzkomórkowych poruszają się i pojawiają się na powierzchni błony komórkowej, gdy pęcherzyki te łączą się z tą błoną..
Przykładem tego mechanizmu są między innymi komórki mięśni szkieletowych i tkanki tłuszczowej.
Receptory insuliny mają stosunkowo krótki okres półtrwania wynoszący około 7 do 12 godzin, więc są stale syntetyzowane i degradowane. U ssaków stężenie receptorów wynosi około 20000 receptorów na komórkę..
Kiedy insulina wiąże się z receptorem, następuje zmiana konformacyjna receptora, sąsiednie receptory poruszają się, wytwarzane są mikroagregaty, a następnie receptor ulega internalizacji. W tym samym czasie generowane są sygnały, które następnie wzmacniają odpowiedzi..
Struktura
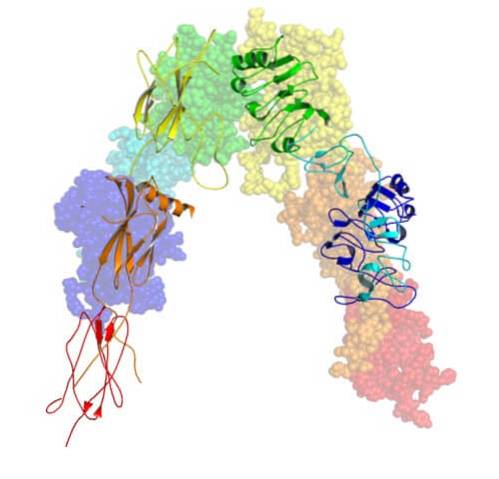
Gen kodujący receptor insulinowy znajduje się na chromosomie 19 i ma 22 egzony. Ten receptor składa się z czterech podjednostek glikoproteiny połączonych wiązaniami disiarczkowymi..
Jest syntetyzowany w retikulum endoplazmatycznym początkowo jako pojedynczy łańcuch polipeptydowy złożony z około 1382 aminokwasów, który jest następnie fosforylowany i rozszczepiany w celu utworzenia podjednostek α i β..
Cztery podjednostki receptora insulinowego to dwie alfa (α) o masie cząsteczkowej 140000 Da i dwie mniejsze beta (β) o przybliżonej masie cząsteczkowej 95000 Da.
Podjednostki α są pozakomórkowe i są odsłonięte na zewnętrznej powierzchni błony komórkowej. Z drugiej strony podjednostki β przechodzą przez błonę i odsłaniają lub wystają na wewnętrzną powierzchnię błony (zwróconą w stronę cytoplazmy).
Podjednostki α zawierają miejsce wiązania insuliny. W jednostkach β znajduje się miejsce wiązania ATP, które aktywuje funkcję kinazy tej podjednostki i indukuje autofosforylację receptora na resztach tyrozyny podjednostki β..
Te receptory są częścią rodziny receptorów związanych z enzymami cytoplazmatycznymi, takimi jak kinaza tyrozynowa, enzym, który jest aktywowany, gdy insulina wiąże się z receptorem i inicjuje proces fosforylacji i defosforylacji szeregu enzymów, które będą odpowiedzialne za efekty , metabolizm insuliny.
funkcje
Podjednostka α receptorów insuliny ma miejsce wiązania dla insuliny. Kiedy ta jednostka wiąże się ze swoim ligandem, zachodzą zmiany konformacyjne w strukturze receptora, które aktywują podjednostki β odpowiedzialne za mechanizmy transdukcji sygnału, a tym samym za działanie insuliny..
W domenach cytoplazmatycznych receptora aktywowana jest kinaza tyrozynowa, która inicjuje przekazywanie sygnałów poprzez kaskadę kinaz. Najpierw następuje fosforylacja lub autofosforylacja receptora insulinowego, a następnie fosforylacja tzw. Substratów receptora insulinowego lub IRS..
Opisano cztery substraty receptora insuliny oznaczone IRS-1, IRS-2, IRS-3 i IRS-4. Ich fosforylacja zachodzi na resztach tyrozyny, seryny i treoniny. Każdy z tych substratów jest powiązany z różnymi kaskadami kinaz zaangażowanymi w metaboliczne działanie insuliny..
Na przykład:
- Wydaje się, że IRS-1 ma związek z wpływem insuliny na wzrost komórek.
- IRS -2 są związane z efektami metabolicznymi hormonu, takimi jak zwiększona synteza glikogenu, lipidów i białek oraz z translokacją białek, takich jak białka receptorowe i białka transportujące glukozę..
Choroby
Cukrzyca to choroba dotykająca bardzo duży procent światowej populacji i związana z defektami w produkcji insuliny, ale także z wadliwą funkcją receptorów insulinowych.
Istnieją dwa rodzaje cukrzycy: cukrzyca typu I lub cukrzyca młodzieńcza, która jest insulinozależna, oraz cukrzyca typu II lub cukrzyca dorosłych, która nie jest insulinozależna..
Cukrzyca typu I jest spowodowana niewystarczającą produkcją insuliny i wiąże się z hiperglikemią i kwasicą ketonową. Cukrzyca typu II jest związana z czynnikami genetycznymi, które wpływają zarówno na produkcję insuliny, jak i funkcję receptorów, i jest związana z hiperglikemią bez kwasicy ketonowej.
Bibliografia
- American Diabetes Association. (2010). Diagnoza i klasyfikacja cukrzycy. Opieka diabetologiczna, 33 (suplement 1), S62-S69.
- Berne, R., & Levy, M. (1990). Fizjologia. Mosby; Edycja międzynarodowa.
- Fox, S. I. (2006). Human Physiology (9th ed.). Nowy Jork, USA: McGraw-Hill Press.
- Guyton, A. i Hall, J. (2006). Podręcznik fizjologii medycznej (wyd. 11). Elsevier Inc.
- Lee, J. i Pilch, P. F. (1994). Receptor insulinowy: budowa, funkcja i sygnalizacja. American Journal of Physiology-Cell Physiology, 266 (2), C319-C334.



Jeszcze bez komentarzy