
Historia, właściwości, budowa, pozyskiwanie, zastosowania krzemu
Plik krzem Jest to niemetaliczny i jednocześnie metaloidalny pierwiastek, który jest reprezentowany przez symbol chemiczny Si. Jest to półprzewodnik, który jest istotną częścią komputerów, kalkulatorów, telefonów komórkowych, ogniw słonecznych, diod itp.; Jest to praktycznie główny składnik, który umożliwił ustanowienie ery cyfrowej.
Krzem zawsze był obecny w kwarcu i krzemianach, które stanowią około 28% masy całej skorupy ziemskiej. Jest to zatem drugi najbardziej rozpowszechniony pierwiastek na powierzchni Ziemi, a ogrom pustyń i plaż daje perspektywę tego, jak obfituje..

Krzem należy do grupy 14 układu okresowego, podobnie jak węgiel znajdujący się pod nim. Dlatego ten pierwiastek jest uważany za czterowartościowy metaloid; Ma cztery elektrony walencyjne i teoretycznie może stracić je wszystkie, tworząc kation Si4+.
Jedną z właściwości, które dzieli z węglem, jest jego zdolność do łączenia się; to znaczy, że ich atomy są kowalencyjnie połączone, aby zdefiniować łańcuchy molekularne. Podobnie krzem może tworzyć własne „węglowodory”, zwane silanami..
Dominującymi związkami krzemu w przyrodzie są słynne krzemiany. W czystej postaci może występować jako ciało stałe monokrystaliczne, polikrystaliczne lub bezpostaciowe. Jest to stosunkowo obojętne ciało stałe, więc nie stanowi dużego ryzyka.
Indeks artykułów
- 1 Historia
- 1.1 Kamień silikonowy
- 1.2 Izolacja
- 1.3 Krystaliczny krzem
- 2 Właściwości fizyczne i chemiczne
- 2.1 Wygląd fizyczny
- 2.2 Masa molowa
- 2.3 Liczba atomowa (Z)
- 2.4 Temperatura topnienia
- 2.5 Temperatura wrzenia
- 2.6 Gęstość
- 2.7 Ciepło topnienia
- 2.8 Ciepło parowania
- 2,9 Molowa pojemność cieplna
- 2.10 Elektroujemność
- 2.11 Energie jonizacji
- 2.12 Promień atomowy
- 2.13 Przewodność cieplna
- 2.14 Oporność elektryczna
- 2,15 Twardość Mohsa
- 2.16 Łączenie
- 2.17 stopni utlenienia
- 2.18 Reaktywność
- 3 Struktura i konfiguracja elektroniczna
- 3.1 Charakter kowalencyjny
- 3.2 Przewodność elektryczna
- 3.3 Amorficzny krzem
- 4 Gdzie znaleźć i otrzymać
- 4.1 -Redukcja krzemionki
- 5 izotopów
- 6 Ryzyka
- 7 zastosowań
- 7.1 Przemysł budowlany
- 7.2 Szkło i ceramika
- 7.3 Stopy
- 7.4 Osuszacze
- 7.5 Przemysł elektroniczny
- 7.6 Polimery silikonowe
- 8 Odniesienia
Fabuła
Kamień silikonowy
Krzem jest prawdopodobnie jednym z pierwiastków, który wywarł największy wpływ w historii ludzkości.
Ten element jest bohaterem epoki kamienia, a także epoki cyfrowej. Jego początki sięgają czasów, gdy cywilizacje pracowały kiedyś z kwarcem i tworzyły własne okulary; a obecnie jest głównym składnikiem komputerów, laptopów i smartfonów.
Krzem był praktycznie kamieniem dwóch jasno określonych epok w naszej historii.
Izolacja
Ponieważ krzemionka jest tak obfita, nazwa zrodzona z krzemiennej skały, musiała zawierać niezwykle bogaty pierwiastek w skorupie ziemskiej; takie było słuszne podejrzenie Antoine'a Lavoisiera, który w 1787 roku nie zdołał usunąć go z rdzy.
Jakiś czas później, w 1808 roku, Humphry Davy podjął własne próby i nadał temu pierwiastkowi imię: „krzem”, co w tłumaczeniu oznaczało „krzemień”. Oznacza to, że krzem był wówczas uważany za metal ze względu na jego brak charakterystyki..
Następnie w 1811 roku francuskim chemikom Josephowi L. Gay-Lussacowi i Louisowi Jacquesowi Thénardowi po raz pierwszy udało się przygotować bezpostaciowy krzem. W tym celu poddali reakcji czterofluorek krzemu z metalicznym potasem. Nie dokonali jednak oczyszczenia ani nie scharakteryzowali uzyskanego produktu, więc nie doszli do wniosku, że jest to nowy pierwiastek krzemowy.
Dopiero w 1823 r. Szwedzki chemik Jacob Berzelius uzyskał bezpostaciowy krzem o wystarczającej czystości, aby rozpoznać go jako krzem; nazwa nadana w 1817 roku przez szkockiego chemika Thomasa Thomsona, uznając go za pierwiastek niemetaliczny. Berzelius przeprowadził reakcję między fluorokrzemianem potasu i stopionym potasem w celu wytworzenia tego krzemu.
Krystaliczny krzem
Krystaliczny krzem został po raz pierwszy przygotowany w 1854 roku przez francuskiego chemika Henry'ego Deville'a. W tym celu Deville przeprowadził elektrolizę mieszaniny chlorków glinu i sodu, uzyskując w ten sposób kryształy krzemu pokryte warstwą krzemku glinu, które wyeliminował (podobno) przemywając je wodą..
Fizyczne i chemiczne właściwości
Wygląd fizyczny

Krzem w swojej czystej lub elementarnej postaci składa się z szarawego lub niebieskawo-czarnego ciała stałego (górne zdjęcie), które chociaż nie jest metalem, ma błyszczące powierzchnie, jakby naprawdę było.
Jest to twarde, ale kruche ciało stałe, które również wykazuje łuszczącą się powierzchnię, jeśli składa się z polikryształów. Z drugiej strony amorficzny krzem wygląda jak ciemnobrązowe sproszkowane ciało stałe. Dzięki temu łatwo jest zidentyfikować i odróżnić jeden rodzaj krzemu (krystaliczny lub polikrystaliczny) od drugiego (amorficzny).
Masa cząsteczkowa
28,085 g / mol
Liczba atomowa (Z)
14 (14Tak)
Temperatura topnienia
1414 ºC
Temperatura wrzenia
3265 ºC
Gęstość
-W temperaturze pokojowej: 2,33 g / ml
-Bezpośrednio w temperaturze topnienia: 2,57 g / ml
Należy zauważyć, że ciekły krzem jest gęstszy niż stały; co oznacza, że jego kryształy będą unosić się na tej samej fazie ciekłej, jak to ma miejsce w układzie woda-lód. Wyjaśnienie wynika z faktu, że przestrzeń międzyatomowa między atomami krzemu w ich krysztale jest większa (mniej gęsta) niż odpowiadająca jej w cieczy (gęstsza).
Ciepło topnienia
50,21 kJ / mol
Ciepło parowania
383 kJ / mol
Molowa pojemność cieplna
19,789 J / (mol K)
Elektroujemność
1,90 w skali Paulinga
Energie jonizacji
-Pierwsza: 786,5 kJ / mol
-Po drugie: 1577,1 kJ / mol
-Po trzecie: 3231,6 kJ / mol
Radio atomowe
111 pm (mierzone na odpowiednich kryształach diamentu)
Przewodność cieplna
149 W / (m · K)
Rezystancja
2,3 103 Ω · m przy 20 ºC
Twardość Mohsa
6.5
Powiązanie
Atomy krzemu mają zdolność tworzenia prostych wiązań Si-Si, które ostatecznie definiują łańcuch (Si-Si-Si…).
Ta właściwość przejawia się również w węglu i siarki; jednak hybrydyzacje sp3 krzem jest bardziej ubogi w porównaniu z pozostałymi dwoma pierwiastkami, a ponadto ich orbitale 3p są bardziej rozproszone, więc nakładanie się orbitali sp3 wynikowe jest słabsze.
Średnie energie wiązań kowalencyjnych Si-Si i C-C wynoszą odpowiednio 226 kJ / mol i 356 kJ / mol. Dlatego wiązania Si-Si są słabsze. Z tego powodu krzem nie jest kamieniem węgielnym życia (podobnie jak siarka). W rzeczywistości najdłuższy łańcuch lub szkielet, jaki może utworzyć krzem, jest zwykle czteroczłonowy (Si4).
Liczby utleniania
Krzem może mieć dowolną z następujących stopni utlenienia, zakładając w każdym z nich istnienie jonów o odpowiednich ładunkach: -4 (Si4-), -3 (Tak3-), -2 (Takdwa-), -1 (Tak-), +1 (Tak+), +2 (Takdwa+), +3 (Tak3+) i +4 (Tak4+). Spośród nich najważniejsze są -4 i +4.
Na przykład zakłada się -4 w krzemkach (MgdwaTak lub Mgdwadwa+tak4-); podczas gdy +4 odpowiada krzemionce (SiOdwa albo jeśli4+LUBdwadwa-).
Reaktywność
Krzem jest całkowicie nierozpuszczalny w wodzie, podobnie jak mocne kwasy czy zasady. Jednak rozpuszcza się w stężonej mieszaninie kwasu azotowego i fluorowodorowego (HNO3-HF). Podobnie rozpuszcza się w gorącym roztworze zasadowym, w wyniku czego zachodzi następująca reakcja chemiczna:
Si (s) + 2 NaOH (aq) + HdwaO (l) => Nadwatak3(aq) + 2Hdwa(sol)
Sól metakrzemianu sodu, Nadwatak3, Powstaje również, gdy krzem rozpuszcza się w stopionym węglanie sodu:
Si (s) + NadwaWSPÓŁ3(l) => Nadwatak3(l) + C (s)
W temperaturze pokojowej w ogóle nie reaguje z tlenem, nawet przy 900 ºC, gdy zaczyna tworzyć się ochronna szklista warstwa SiOdwa; a następnie w 1400 ° C krzem reaguje z azotem w powietrzu, tworząc mieszaninę azotków, SiN i Si3N4.
Krzem reaguje również w wysokich temperaturach z metalami, tworząc krzemki metali:
2Mg (s) + Si (s) => MgdwaTak (s)
2Cu (s) + Si (s) => CudwaTak (s)
W temperaturze pokojowej reaguje wybuchowo i bezpośrednio z halogenami (nie ma warstwy SiOdwa aby cię przed tym chronić). Na przykład mamy reakcję tworzenia SiF4:
Tak (s) + 2Fdwa(g) => SiF4(sol)
I chociaż krzem jest nierozpuszczalny w wodzie, reaguje na gorąco ze strumieniem pary:
Tak (s) + H.dwaO (g) => SiOdwa(s) + 2Hdwa(sol)
Struktura i konfiguracja elektroniczna
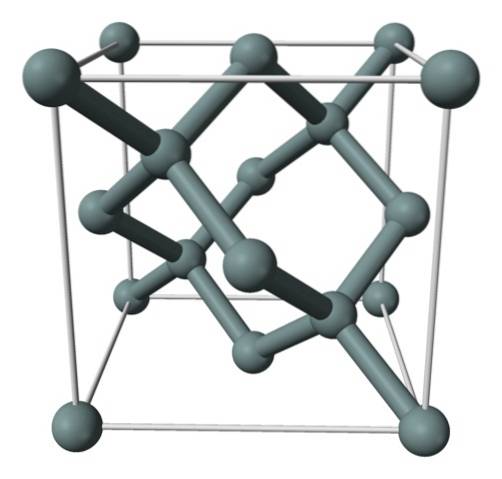
Powyższy obrazek przedstawia strukturę sześcienną centrowaną na powierzchni (fcc), taką samą jak diament, dla kryształu krzemu. Szarawe kule odpowiadają atomom Si, które, jak widać, są ze sobą kowalencyjnie połączone; ponadto mają tetraedryczne środowiska, które są odtwarzane wzdłuż kryształu.
Kryształ krzemu jest fcc, ponieważ atom Si znajduje się na każdej ze ścian sześcianu (6 × 1/2). Podobnie, na wierzchołkach sześcianu znajduje się osiem atomów Si (8 × 1/8), a cztery znajdują się w nim (te, które mają wokół siebie dobrze zdefiniowany czworościan, 4 × 1).
To powiedziawszy, każda komórka elementarna ma łącznie osiem atomów krzemu (3 + 1 + 4, liczby wskazane w powyższym akapicie); cecha, która pomaga wyjaśnić jego wysoką twardość i sztywność, ponieważ czysty krzem jest kryształem kowalencyjnym podobnym do diamentu.
Charakter kowalencyjny
Ten kowalencyjny charakter wynika z faktu, że krzem, podobnie jak węgiel, ma cztery elektrony walencyjne zgodnie z jego konfiguracją elektroniczną:
[Ne] 3sdwa 3pdwa
Do klejenia czyste orbitale 3s i 2p są bezużyteczne. Dlatego atom tworzy cztery hybrydowe orbitale sp3, z którym może tworzyć cztery wiązania kowalencyjne Si-Si iw ten sposób uzupełnić oktet walencyjny dla dwóch atomów krzemu.
Kryształ krzemu jest następnie wizualizowany jako kowalencyjna, trójwymiarowa sieć złożona z połączonych ze sobą czworościanów..
Jednak ta sieć nie jest doskonała, ponieważ ma wady i granice ziaren, które oddzielają i definiują jeden kryształ od drugiego; a kiedy takie kryształy są bardzo małe i liczne, mówimy o polikrystalicznym ciele stałym, identyfikowanym przez jego niejednorodny połysk (podobny do srebrnej mozaiki lub łuskowatej powierzchni).
Przewodność elektryczna
Wiązania Si-Si, z ich dobrze zlokalizowanymi elektronami, w zasadzie nie zgadzają się z tym, czego oczekuje się od metalu: morze elektronów „zwilżających” jego atomy; przynajmniej tak jest w temperaturze pokojowej.
Jednak wraz ze wzrostem temperatury krzem zaczyna przewodzić elektryczność i dlatego zachowuje się jak metal; to znaczy jest metaloidalnym elementem półprzewodnikowym.
Krzem amorficzny
Czworościany krzemu nie zawsze przyjmują wzór strukturalny, ale mogą być ułożone w nieuporządkowany sposób; a nawet z atomami krzemu, których hybrydyzacje nie wydają się być sp3 ale spdwa, co przyczynia się do dalszego zwiększania stopnia zaburzenia. Dlatego mówimy o amorficznym i niekrystalicznym krzemie.
W krzemie amorficznym występują wakaty elektronowe, w których niektóre z jego atomów mają orbital z niesparowanym elektronem. Dzięki temu jego ciało stałe może ulegać uwodornieniu, co prowadzi do powstania uwodornionego bezpostaciowego krzemu; to znaczy ma wiązania Si-H, z którymi czworościany są zakończone w nieuporządkowanych i arbitralnych pozycjach.
Ta sekcja kończy się następnie stwierdzeniem, że krzem może występować w trzech rodzajach ciał stałych (nie wspominając o jego stopniu czystości): krystalicznej, polikrystalicznej i amorficznej..
Każdy z nich ma własną metodę lub proces produkcji, a także swoje zastosowania i kompromisy przy podejmowaniu decyzji, który z trzech użyć, znając jego zalety i wady..
Gdzie znaleźć i uzyskać

Krzem jest siódmym najbardziej rozpowszechnionym pierwiastkiem we Wszechświecie i drugim w skorupie ziemskiej, wzbogacającym także płaszcz Ziemi o jego rozległą rodzinę minerałów. Pierwiastek ten bardzo dobrze kojarzy się z tlenem, tworząc szeroką gamę tlenków; wśród nich krzemionka, SOdwa, i krzemiany (o zróżnicowanym składzie chemicznym).
Krzemionkę można zobaczyć gołym okiem na pustyniach i plażach, ponieważ piasek składa się głównie z SiOdwa. Z kolei tlenek ten może występować w kilku odmianach polimorficznych, z których najczęstsze to: kwarc, ametyst, agat, krystobalit, trypolis, koezyt, stiszowit i trydymit. Ponadto można go znaleźć w amorficznych ciałach stałych, takich jak opale i ziemia okrzemkowa..
Tymczasem krzemiany są jeszcze bogatsze strukturalnie i chemicznie. Niektóre z minerałów krzemianowych to: azbest (biały, brązowy i niebieskawy), skalenie, iły, miki, oliwiny, glinokrzemiany, zeolity, amfibole i pirokseny.
Praktycznie wszystkie skały składają się z krzemu i tlenu, z ich stabilnymi wiązaniami Si-O, a ich krzemionki i krzemiany są zmieszane z tlenkami metali i związkami nieorganicznymi..
-Redukcja krzemionki
Problemem uzyskania krzemu jest zerwanie wspomnianego wiązania Si-O, do którego potrzebne są specjalne piece i dobra strategia redukcji. Surowcem do tego procesu jest krzemionka w postaci kwarcu, który jest uprzednio mielony na drobny proszek..
Z tej zmielonej krzemionki można otrzymać krzem amorficzny lub polikrystaliczny..
Krzem amorficzny
Na małą skalę, prowadzoną w laboratorium i przy zastosowaniu odpowiednich środków, krzemionkę miesza się z proszkiem magnezu w tyglu i spala bez dostępu powietrza. Następuje wtedy następująca reakcja:
takdwa(s) + Mg (s) => 2MgO (s) + Si (s)
Magnez i jego tlenek usuwa się rozcieńczonym roztworem kwasu solnego. Następnie pozostałą substancję stałą traktuje się kwasem fluorowodorowym, tak że SiO przestaje reagowaćdwa w nadmiarze; w przeciwnym razie nadmiar magnezu sprzyja tworzeniu się jego odpowiedniego krzemku, MgdwaTak, niepożądany związek do procesu.
SiOdwa staje się lotnym gazem SiF4, który jest odzyskiwany do innych syntez chemicznych. Na koniec bezpostaciowa masa krzemowa jest suszona w strumieniu gazowego wodoru..
Inną podobną metodą otrzymywania amorficznego krzemu jest użycie tego samego SiF4 wcześniej wyprodukowany lub SiCl4 (zakupiony wcześniej). Opary tych halogenków krzemu przechodzą nad ciekłym sodem w obojętnej atmosferze, dzięki czemu redukcja gazu może odbywać się bez obecności tlenu:
SiCl4(g) + 4Na (l) => Si (s) + 4NaCl (l)
Co ciekawe, do produkcji wysokowydajnych paneli słonecznych używa się amorficznego krzemu.
Krystaliczny krzem
Zaczynając ponownie ze sproszkowanej krzemionki lub kwarcu, są przenoszone do elektrycznego pieca łukowego, gdzie reagują z koksem. W ten sposób środek redukujący nie jest już metalem, ale materiałem węglowym o wysokiej czystości:
takdwa(s) + 2C (s) => Si (s) + 2CO (g)
W wyniku reakcji powstaje również węglik krzemu SiC, który jest neutralizowany nadmiarem SiOdwa (znowu kwarc jest w nadmiarze):
2SiC (s) + SiOdwa(s) => 3Si (s) + 2CO (g)
Inną metodą przygotowania krzemu krystalicznego jest użycie aluminium jako środka redukującego:
3 TAKdwa(s) + 4Al (l) => 3Si (s) + 2AldwaLUB3(s)
A zaczynając od heksafluorokrzemianu potasu, Kdwa[SiF6], jest również poddawany reakcji z metalicznym glinem lub potasem w celu wytworzenia tego samego produktu:
K.dwa[SiF6] (l) + 4Al (l) => 3Si (s) + 6KF (l) + 4AlF3(sol)
Krzem natychmiast rozpuszcza się w stopionym aluminium, a po schłodzeniu układu pierwszy krystalizuje i oddziela się od drugiego; to znaczy, powstają kryształy krzemu, które mają szarawe kolory.
Krzem polikrystaliczny
W przeciwieństwie do innych syntez lub produkcji, aby otrzymać krzem polikrystaliczny, należy zacząć od fazy gazowej silanu, SiH4. Gaz ten jest poddawany pirolizie powyżej 500 ºC w taki sposób, że następuje rozkład termiczny, a tym samym polikryształy krzemu osadzają się z początkowych par na powierzchni półprzewodnika.
Następujące równanie chemiczne ilustruje zachodzącą reakcję:
tak h4(g) => Si (s) + Hdwa(sol)
Oczywiście w komorze nie powinno być tlenu, ponieważ reagowałby on z SiH4:
tak h4(g) + 2Odwa(g) => SiOdwa(s) + 2HdwaO (g)
I taka jest samorzutność reakcji spalania, że zachodzi ona szybko w temperaturze pokojowej przy minimalnym wystawieniu silanu na działanie powietrza..
Inna droga syntezy do produkcji tego typu krzemu zaczyna się od krystalicznego krzemu jako surowca. Dzięki nim reaguje z chlorowodorem w temperaturze około 300 ºC, w wyniku czego powstaje trichlorosilan:
Si (s) + 3HCl (g) => SiCl3H (g) + Hdwa(sol)
A SiCl3H reaguje w 1100 ºC, regenerując krzem, ale teraz polikrystaliczny:
4SiCl3H (g) => Si (s) + 3SiCl4(g) + 2Hdwa(sol)
Wystarczy spojrzeć na równania, aby zorientować się w pracy i rygorystycznych parametrach produkcji, które należy wziąć pod uwagę..
Izotopy
Krzem występuje naturalnie i głównie jako izotop 28Tak, z obfitością 92,23%.
Oprócz tego istnieją dwa inne izotopy, które są stabilne i dlatego nie ulegają rozpadowi radioaktywnemu: 29Tak, z obfitością 4,67%; Y 30Tak, z obfitością 3,10%. Bycie tak obfitym 28Tak, nic dziwnego, że masa atomowa krzemu wynosi 28,084 jednostek.
Krzem można również znaleźć w kilku radioizotopach, wśród których są 31Tak (t1/2= 2,62 godziny) i 32Tak (t1/2= 153 lata). Inni (22tak - 44Jeśli oni mają t1/2 bardzo krótkie lub krótkie (mniej niż setne części sekundy).
Ryzyka
Czysty krzem jest substancją względnie obojętną, więc zwykle nie gromadzi się w żadnym narządzie ani tkance, o ile narażenie na jego działanie jest niskie. W postaci proszku może podrażniać oczy, powodując łzawienie lub zaczerwienienie, a dotykanie może powodować dyskomfort skóry, swędzenie i łuszczenie..
Kiedy narażenie jest bardzo wysokie, krzem może uszkodzić płuca; ale bez następstw, chyba że ilość jest wystarczająca, aby spowodować uduszenie. Jednak tak nie jest w przypadku kwarcu, który jest związany z rakiem płuc i chorobami, takimi jak zapalenie oskrzeli i rozedma płuc..
Podobnie czysty krzem występuje w przyrodzie bardzo rzadko, a jego związki, tak obfite w skorupie ziemskiej, nie stanowią żadnego zagrożenia dla środowiska..
Teraz, jeśli chodzi o krzemoorganiczny, mogą one być toksyczne; Ale ponieważ jest ich wiele, zależy to od tego, który z nich jest brany pod uwagę, a także od innych czynników (reaktywność, pH, mechanizm działania itp.).
Aplikacje
Przemysł budowlany
Minerały krzemowe tworzą „kamień”, z którego buduje się budynki, domy lub pomniki. Na przykład cementy, betony, sztukaterie i cegły ogniotrwałe składają się ze stałych mieszanin na bazie krzemianów. Z tego podejścia można wyobrazić sobie przydatność tego pierwiastka w miastach i architekturze..
Szkło i ceramika
Kryształy stosowane w urządzeniach optycznych mogą być wykonane z krzemionki, czy to jako izolatory, celki do próbek, spektrofotometry, kryształy piezoelektryczne czy zwykłe soczewki..
Podobnie, gdy materiał jest przygotowany z wieloma dodatkami, ostatecznie przekształca się w bezpostaciową substancję stałą, dobrze znaną jako szkło; a góry piasku są zwykle źródłem krzemionki lub kwarcu potrzebnego do jego produkcji. Z drugiej strony z krzemianów produkowane są materiały ceramiczne i porcelana.
Przeplatając się idei, krzem jest również obecny w rzemiośle i zdobnictwie.
Stopy
Atomy krzemu mogą się łączyć i mieszać z metalową osnową, co czyni go dodatkiem do wielu stopów lub metali; na przykład stal do produkcji rdzeni magnetycznych; brązy do produkcji kabli telefonicznych; oraz aluminium w produkcji stopu aluminiowo-krzemowego przeznaczonego na lekkie części samochodowe.
Dlatego można go znaleźć nie tylko w „kamieniu” budynków, ale także w metalach ich kolumn..
Desykanty

Krzemionka w postaci żelu lub amorficznej umożliwia wytwarzanie ciał stałych, które działają jak środki osuszające, zatrzymując cząsteczki wody, które dostają się do pojemnika i utrzymując jego wnętrze w stanie suchym..
Przemysł elektroniczny

Warstwy krzemu o różnych grubościach i kolorach są częścią chipów komputerowych, podobnie jak w przypadku ich stałych (krystalicznych lub amorficznych), zaprojektowano układy scalone i ogniwa słoneczne.
Będąc półprzewodnikiem, zawiera atomy z mniejszą (Al, B, Ga) lub większą liczbą elektronów (P, As, Sb), aby przekształcić go w półprzewodniki typu p lub n, odpowiednio. Ze złączami dwóch silikonów, jeden n i inni p, produkowane są diody elektroluminescencyjne.
Polimery silikonowe
Słynny klej silikonowy składa się z organicznego polimeru wspieranego przez stabilność łańcuchów wiązań Si-O-Si ... Jeśli te łańcuchy są bardzo długie, krótkie lub usieciowane, zmieniają się właściwości polimeru silikonowego, a także ostateczne zastosowania..
Wśród jego zastosowań, wymienionych poniżej, można wymienić:
-Kleje lub spoiwa, nie tylko do łączenia papierów, ale także bloczków budowlanych, gumy, tafli szklanych, kamieni itp..
-Smary w hydraulicznych układach hamulcowych
-Wzmacnia farby oraz poprawia jasność i intensywność ich kolorów, jednocześnie pozwalając im wytrzymać zmiany temperatury bez pękania i zjadania.
-Stosowane są jako spraye hydrofobowe, które utrzymują suchość niektórych powierzchni lub przedmiotów
-Nadają produktom higieny osobistej (pasty do zębów, szampony, żele, kremy do golenia itp.) Uczucie jedwabistości
-Jego powłoki chronią podzespoły elektroniczne delikatnych urządzeń, takich jak mikroprocesory, przed ciepłem i wilgocią
-W przypadku polimerów silikonowych wykonano kilka gumowych kulek, które odbijają się, gdy tylko spadną na podłogę..
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Krzem. Odzyskane z: en.wikipedia.org
- MicroChemicals. (s.f.). Krystalografia krzemu. Odzyskane z: microchemicals.com
- Lenntech B.V. (2019). Układ okresowy: krzem. Odzyskany z: lenntech.com
- Marques Miguel. (s.f.). Występowanie krzemu. Odzyskany z: nautilus.fis.uc.pt
- Więcej Hemant. (5 listopada 2017). Krzem. Źródło: hemantmore.org.in
- Pilgaard Michael. (22 sierpnia 2018). Krzem: występowanie, izolacja i synteza. Odzyskane z: pilgaardelements.com
- Dr Doug Stewart. (2019). Fakty dotyczące pierwiastków krzemu. Chemicool. Źródło: chemicool.com
- Christiana Honsberg i Stuart Bowden. (2019). Zbiór zasobów dla edukatora fotowoltaiki. PVedukacja. Odzyskany z: pveducation.org
- American Chemistry Council, Inc. (2019). Silikony w życiu codziennym. Odzyskane z: sehsc.americanchemistry.com



Jeszcze bez komentarzy