
Struktura ciała stałego krystalicznego, właściwości, rodzaje, przykłady

Plik krystaliczne ciała stałe To ci, których mikroskopijne struktury są uporządkowane i zgodne z charakterystycznym wzorem dla danej sieci krystalicznej; na przykład: między innymi sześcienny, sześciokątny, trójskośny, romboedryczny.
Mówi się, że te ciała stałe istnieją jako kryształy, ukazując fasetki i wzory geometryczne, które odzwierciedlają ich uporządkowanie w środku. Innymi przykładami krystalicznych ciał stałych są diament, kwarc, antracen, suchy lód, chlorek potasu lub tlenek magnezu..

Dobrze znaną parą krystalicznych ciał stałych jest cukier i sól (NaCl). Na pierwszy rzut oka oba mają białe kryształy; ale ich właściwości ogromnie się różnią. Cukier jest molekularną krystaliczną substancją stałą, podczas gdy sól jest jonową krystaliczną substancją stałą. Pierwsza składa się z cząsteczek sacharozy; a druga - jonów Na+ i Cl-.
Powyższy obrazek daje wgląd w to, jak jasne mogą być kryształy cukru. Kryształy soli nie są jednak daleko w tyle. Chociaż cukier i sól wydają się braćmi, ich budowa jest inna: cukier, którym jest sacharoza, ma strukturę jednoskośną; podczas gdy sól, struktura sześcienna.
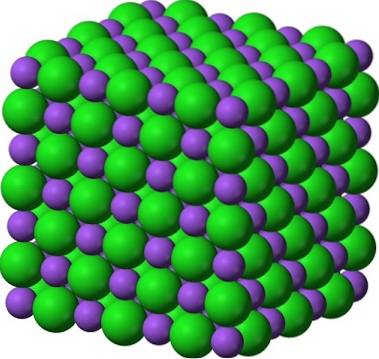
Cukier puder i sól (lukier) pozostają krystaliczne; jego kryształy stały się tylko o wiele mniejsze dla naszych oczu. Zatem krystaliczność ciała stałego jest definiowana bardziej przez jego wewnętrzną strukturę niż przez jego wygląd zewnętrzny lub jasność..
Indeks artykułów
- 1 Struktura krystalicznych ciał stałych
- 2 Właściwości
- 3 Rodzaje krystalicznych ciał stałych
- 3.1 Ionic
- 3.2 Metaliczne
- 3.3 Molekularne
- 3.4 Sieci kowalencyjne
- 4 Przykłady
- 4.1 Ionic
- 4.2 Metaliczne
- 4.3 Molekularne
- 4.4 Sieci kowalencyjne
- 5 Referencje
Struktura krystalicznych ciał stałych
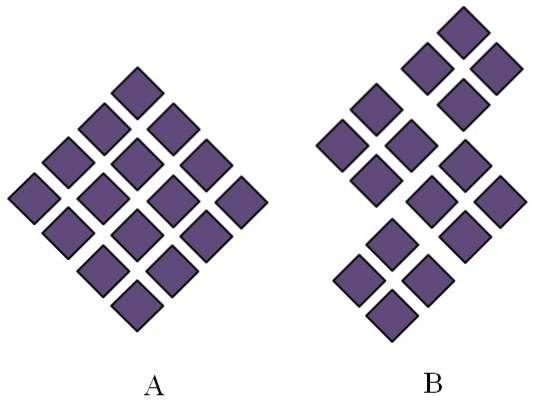
Krystaliczne ciała stałe mają uporządkowaną strukturę. Ich właściwości geometryczne będą zależały od rodzaju sieci krystalicznej, do której należą, która z kolei jest rzutowana na zewnątrz w postaci kryształu (układ krystaliczny). Powyższy obraz ilustruje dwie ważne koncepcje takich struktur: okresowość i ziarna krystaliczne..
Przestrzenne uporządkowanie cząstek krystalicznego ciała stałego jest okresowe; to znaczy, powtarza się w kółko we wszystkich kierunkach. Tworzy to własny wzór strukturalny dla każdej sieci stałej i krystalicznej; na przykład w tym miejscu sól i cukier zaczynają się różnicować, wykraczając poza ich chemiczny charakter.
W A romb są ułożone tak, aby tworzyły romb o większych proporcjach. Każdy purpurowy romb reprezentuje cząsteczkę lub zbiór cząstek (atomów, jonów lub cząsteczek). Zatem można oczekiwać, że makroskopowy kryształ A będzie miał wygląd romboedryczny..
Tymczasem w B romby ułożone są w taki sposób, że dają początek ziarenkom krystalicznym; są to bardzo małe kryształy (krystality). B jest wówczas określane jako polikrystaliczne ciało stałe; to znaczy, że jest tworzony przez aglomerację wielu krystalitów.
Podsumowując, ciało stałe może być po prostu krystaliczne (A) lub polikrystaliczne (B); A tworzy kryształy, a B polikryształy.
Nieruchomości
Właściwości krystalicznych ciał stałych zależą od ich rodzaju kryształu. Wiadomo już, że ich struktury są uporządkowane, a także mają tendencję do prezentowania jasnych cech, w których zakochują się miłośnicy minerałów. Wspomniano jednak, że sproszkowane ciało stałe, nawet „wyłączone”, można również sklasyfikować jako krystaliczne..
Sposób, w jaki ich cząstki są zorientowane przestrzennie, pozwala im mieć pewne ważne właściwości do ich scharakteryzowania. Na przykład krystaliczne ciała stałe są zdolne do dyfrakcji promieni rentgenowskich, tworząc widma dyfrakcyjne, na podstawie których można określić mikroskopijną strukturę kryształu..
Ponadto, ponieważ struktura jest okresowa, ciepło rozchodzi się w ten sam sposób w całym ciele stałym; o ile nie ma zanieczyszczeń. Zatem temperatury topnienia krystalicznej substancji stałej są stałe i nie zmieniają się bez względu na sposób ich pomiaru..
Rodzaje krystalicznych ciał stałych
Typy krystalicznych ciał stałych zależą od rodzaju cząstek, z których są zbudowane i jakie są ich interakcje lub wiązania. Istnieją zasadniczo cztery typy: sieci jonowe, metaliczne, molekularne i kowalencyjne.
Nawet jeśli zawierają pewien stopień zanieczyszczeń, nadal są krystaliczne, mimo że wpływa to na ich właściwości i nie wykazują takich samych wartości, jakich oczekuje się dla czystego ciała stałego..
Joniki
Sól jest przykładem jonowego krystalicznego ciała stałego, ponieważ składa się z jonów Na+ i Cl-. Dlatego w tego typu ciałach stałych rządzi wiązanie jonowe: to siły elektrostatyczne rządzą porządkiem strukturalnym..
Metaliczny
Wszystkie atomy metalu tworzą metaliczne kryształy. Oznacza to, że na przykład srebrny widelec jest konglomeratem stopionych srebrnych kryształów. Struktura wewnętrzna lub mikroskopijna jest taka sama w każdej rozpiętości dłoni przedmiotu i pozostaje niezmieniona od rękojeści widelca do czubka zębów..
Molekularny
Cukier jest przykładem molekularnej krystalicznej substancji stałej, ponieważ składa się z cząsteczek sacharozy. Dlatego ten typ ciała stałego składa się z cząsteczek, które poprzez swoje interakcje międzycząsteczkowe (a nie wiązania kowalencyjne) potrafią ustanowić uporządkowaną strukturę..
Sieci kowalencyjne
Wreszcie mamy krystaliczne ciała stałe sieci kowalencyjnych. Przeważają w nich wiązania kowalencyjne, które odpowiadają za ustalenie porządku i utrzymanie silnego unieruchomienia atomów w odpowiednich pozycjach przestrzennych. Nie mówimy o jonach, atomach czy cząsteczkach, ale o trójwymiarowych sieciach.
Przykłady
Na koniec przytoczę kilka przykładów dla każdego z typów krystalicznych ciał stałych.
Joniki
Wszystkie sole są jonowymi ciałami stałymi. Podobnie istnieją siarczki, wodorotlenki, tlenki, halogenki i inne związki, które również składają się z jonów lub ich interakcje są zasadniczo jonowe. Więc mamy:
-KCl
-Walizka4
-Ba (OH)dwa
-KIERUNEK4
-FeCl3
-NadwaS
-MgO
-CaFdwa
-NaHCO3
-(NH4)dwaCrO4
Oprócz tych przykładów zdecydowana większość minerałów jest uważana za jonowe krystaliczne ciała stałe.
Metaliczny
Każdy pierwiastek metaliczny występuje naturalnie jako metaliczne kryształy. Niektórzy z nich są:
-Miedź
-Żelazo
-Aluminium
-Chrom
-Metaliczny wodór (pod niewyobrażalnym ciśnieniem)
-Wolfram
-Cyrkon
-Tytan
-Magnez
-Sód
Molekularny
Istnieje wiele różnych molekularnych krystalicznych ciał stałych. Praktycznie każdy związek organiczny, który zestala się, może tworzyć kryształy, jeśli jego czystość jest wysoka lub jeśli jego struktura nie jest zbyt skomplikowana. Więc mamy:
-Lód (H.dwaLUB)
-Suchy lód (COdwa)
-jadwa
-P.4
-S8 (i jego polimorfy)
-Antracen
-Stały tlen
-Stały amoniak
-Fenoloftaleina
-Kwas benzoesowy
Sieci kowalencyjne
I wreszcie wśród niektórych krystalicznych ciał stałych sieci kowalencyjnych mamy:
-Diament
-Grafit
-Nanorurki węglowe
-Fulereny
-Kwarc
-Krzem
-German
-Azotek boru
Z tej listy nanorurki i fulereny węglowe można również uznać za molekularne krystaliczne ciała stałe. Dzieje się tak, ponieważ chociaż składają się z kowalencyjnie związanych atomów węgla, definiują jednostki, które można wizualizować jako makrocząsteczki (piłki i rurki)..
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2020). Kryształ. Odzyskane z: en.wikipedia.org
- Chemia LibreTexts. (16 czerwca 2019). Krystaliczne i amorficzne ciała stałe. Źródło: chem.libretexts.org
- Rachel Bernstein i Anthony Carpi. (2020). Właściwości ciał stałych. Odzyskany z: visionlearning.com
Jeszcze bez komentarzy