
Struktura, zastosowania, toksyczność siarczanu glinu (Al2 (SO4) 3)

Plik siarczan glinu jest nieorganiczną solą glinu o wzorze Aldwa(POŁUDNIOWY ZACHÓD4)3, który zwykle pojawia się jako białe ciało stałe z błyszczącymi kryształami. Na kolor związku będzie miało wpływ stężenie żelaza i wszelkie inne zanieczyszczenia. Istnieją dwa główne typy siarczanu glinu: A i B..
Dolny obraz przedstawia białe kryształy uwodnionego siarczanu glinu. Można zauważyć brak brązowych zabarwień, wskazujących na obecność jonów żelaza w sieci krystalicznej.

Siarczan glinu jest solą bardzo dobrze rozpuszczalną w wodzie iw naturze rzadko występuje go w postaci bezwodnej. Zwykle jest uwodniony w postaci oktadekahydratu siarczanu glinu [Aldwa(POŁUDNIOWY ZACHÓD4)3.18HdwaO] lub heksadekahydrat [Aldwa(POŁUDNIOWY ZACHÓD4)3.16HdwaLUB].
Podobnie może tworzyć sole podwójne z potasem i związkami amonowymi zwanymi ałunami. Po części może to wynikać z powinowactwa wody w hydratach do zatrzymywania jonów innych niż glin..
Siarczan glinu można rozłożyć pod działaniem wody na wodorotlenek glinu i kwas siarkowy. Ta właściwość pozwoliła na zastosowanie go jako zakwaszacza gleby..
Jest również związkiem toksycznym, zwłaszcza w kontakcie z jego pyłem. Ma jednak niezliczone zastosowania i zastosowania, począwszy od oczyszczania wody metodą koagulacji, poprzez zastosowanie w różnych gałęziach przemysłu, aż po wykorzystanie w celach terapeutycznych..
Indeks artykułów
- 1 Struktura
- 2 Do czego służy (zastosowania)
- 2.1 Koagulacja lub flokulacja wody
- 2.2 Używać jako zacierania tuszu i do produkcji papieru
- 2.3 Zastosowania przemysłowe
- 2.4 Zastosowania lecznicze i terapeutyczne
- 2.5 Inne zastosowania
- 3 Produkcja siarczanu glinu
- 4 rodzaje
- 5 Toksyczność
- 6 Odnośniki
Struktura
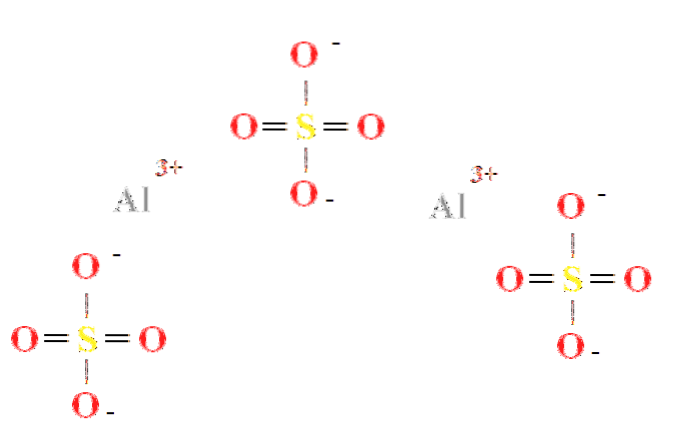
Siarczan glinu ma stosunek dwóch kationów Al3+ na każde trzy aniony SO4dwa- (górne zdjęcie), co widać bezpośrednio w jego wzorze chemicznym Aldwa(POŁUDNIOWY ZACHÓD4)3.
Zwróć uwagę, że Al3+ są szarawe, podczas gdy SO4dwa- są żółte (dla atomu siarki) i czerwone (dla atomów tlenu).
Zilustrowana struktura odpowiada bezwodnej postaci Aldwa(POŁUDNIOWY ZACHÓD4)3, ponieważ żadna cząsteczka wody nie oddziałuje z jonami. Jednak w jego hydratach wodę mogą przyciągać dodatnie centra Al3+, lub przez ujemne czworościany SO4dwa- przez wiązania wodorowe (HOH-O-SO3dwa-).
Aldwa(POŁUDNIOWY ZACHÓD4)3∙ 18HdwaLub, na przykład, zawiera 18 cząsteczek wody w swojej stałej strukturze. Część z nich może mieć bezpośredni kontakt z Al3+ lub z SO4dwa-. Innymi słowy: siarczan glinu może mieć wewnętrzną lub zewnętrzną wodę koordynującą.
Podobnie, jego struktura może zawierać inne kationy, takie jak Fe3+, Na+, K.+, itp. Ale do tego potrzebna jest obecność większej liczby anionów SO4dwa-. Po to aby? Aby zneutralizować wzrost dodatnich ładunków spowodowany zanieczyszczeniami metalicznymi.
Siarczan glinu może mieć wiele struktur, chociaż jego hydraty mają tendencję do przyjmowania jednoskośnego systemu kryształów.
Fizyczne i chemiczne właściwości
Wygląd
Pojawia się jako ciało stałe z błyszczącymi białymi kryształami, granulkami lub proszkiem.
Waga molekularna
342,31 g / mol (bezwodna).
Zapach
Jest bezwonny
Smak
Lekko cierpki słodki smak.
Temperatura topnienia
Postać bezwodna 770 ° C (forma oktadekahydratu 86,5 ° C)
Rozpuszczalność w wodzie
31,2 g / 100 ml w 0 ° C; 36,4 g / 100 ml w 20 ° C i 89 g / 100 ml w 100 ° C.
Gęstość
2,67 do 2,71 g / cm3.
Rozpuszczalność
Słabo rozpuszczalny w alkoholu etylowym.
Ciśnienie pary
Zasadniczo zero.
Stabilność
Stabilny w powietrzu.
Rozkład
Po podgrzaniu, w przybliżeniu do temperatury topnienia, może się rozkładać, wydzielając szczególnie tlenek siarki, który jest toksycznym gazem..
Korozyjność
Roztwory siarczanu glinu powodują korozję aluminium. Podobnie, związek może powodować korozję metali w obecności wilgoci..
pKa
3,3 do 3,6. A jego pH wynosi 2,9 lub więcej w 5% roztworze wodnym.
Do czego służy (zastosowania)
Koagulacja lub flokulacja wody
-Po zmieszaniu z wodą (pitną, serwowaną lub odpadami) siarczan glinu wytwarza wodorotlenek glinu, który tworzy kompleksy ze związkami i cząsteczkami w roztworze, przyspieszając ich sedymentację, co przy braku obróbki siarczanem glinu zajęłoby dużo czasu.
-Siarczan glinu jest również używany do czyszczenia wody basenowej, dzięki czemu jest bardziej atrakcyjny w użyciu..
-Dzięki zastosowaniu siarczanu glinu uzyskuje się wodę pozbawioną zmętnienia i koloru, zwiększając jej zdatność do picia poprzez ułatwienie oczyszczania wody. Niestety ta metoda oczyszczania może prowadzić do nieznacznie zwiększonego stężenia glinu w wodzie..
-Aluminium to bardzo toksyczny metal, który gromadzi się w skórze, mózgu i płucach, powodując poważne zaburzenia. Ponadto nie wiadomo, jaką funkcję spełnia w istotach żywych..
-Unia Europejska wymaga, aby maksymalny dopuszczalny limit glinu w wodzie nie przekraczał 0,2 mg / l. Tymczasem US Enviromental Protection Agency wymaga, aby maksymalny limit zanieczyszczenia wody aluminium nie przekraczał 0,05-0,2 mg / l.
-Oczyszczanie ścieków lub ścieków siarczanem glinu pozwala na ekonomiczną eliminację lub redukcję zawartego w nich fosforu.
Używany jako zaprawa do tuszu i do produkcji papieru
-Siarczan glinu jest stosowany jako zaprawa w barwnikach lub tuszach, pomagając utrwalić się na farbowanym materiale. Jego działanie utrwalające jest spowodowane przez Al (OH)3, którego galaretowata konsystencja współpracuje z adsorpcją barwników na tekstyliach.
-Chociaż jest używany od około 2000 roku pne do opisanego celu, tylko organiczne barwniki wymagają zapraw. Z kolei barwniki syntetyczne nie wymagają zapraw do spełniania swojej funkcji..
-Został wyparty z produkcji papieru, ale nadal jest używany do produkcji masy papierniczej. Usuwa jego zanieczyszczenia, a także służył do wiązania materiałów, neutralizacji ładunków i kalibracji kalafonii..
Zastosowania przemysłowe
-Znajduje zastosowanie w budownictwie w celu przyspieszenia wiązania betonu. Dodatkowo znajduje zastosowanie w hydroizolacji konstrukcji.
-W przemyśle mydlanym i tłuszczowym jest używany do produkcji gliceryny.
-Znajduje zastosowanie w przemyśle naftowym do produkcji syntetycznych katalizatorów, których używają podczas swojej pracy..
-Jest stosowany w przemyśle farmaceutycznym jako środek ściągający przy sporządzaniu leków i kosmetyków.
-Bierze udział w wytwarzaniu barwników, takich jak karmin. Jest również używany jako barwnik do produkcji syntetycznych kauczuków butadienowo-styrenowych..
-W cukrownictwie stosowany jest jako oczyszczacz melasy z trzciny cukrowej.
-Służy do produkcji dezodorantów. Dlaczego? Ponieważ powoduje zwężenie przewodów gruczołów potowych, ograniczając w ten sposób gromadzenie się potu, niezbędnego do wzrostu bakterii powodujących nieprzyjemne zapachy.
-Służy do garbowania skóry, procesu niezbędnego do jej użytkowania. Dodatkowo jest używany do produkcji nawozów.
-Stosowany jest jako dodatek do produkcji farb, klejów i uszczelniaczy, a także środków czystości i pielęgnacji mebli.
Zastosowania lecznicze i terapeutyczne
-Siarczan glinu jest adiuwantem immunologicznym. W związku z tym spełnia funkcję przetwarzania antygenów w taki sposób, że gdy zostaną uwolnione w miejscu działania, wytwarzają większą produkcję przeciwciał dla zaszczepionych antygenów..
-Adiuwant Freunda i BCG, a także inne adiuwanty, w tym endogenne, takie jak interleukiny, są niespecyficzne dla antygenów, umożliwiając zwiększenie promienia działania immunologicznego. Pozwoliło to na opracowanie szczepionek przeciwko licznym chorobom.
-Koagulacyjne działanie siarczanu glinu pozwoliło na eliminację wielu wirusów w uzdatnionej wodzie, m.in .: Q beta, MS2, T4 i P1. Wyniki wskazują, że uzdatnianie wody siarczanem glinu powoduje inaktywację takich wirusów..
-Siarczan glinu jest stosowany w postaci sztyftu lub proszku do leczenia niewielkich powierzchownych ran lub otarć powstałych podczas golenia..
-Jest używany do produkcji octanu glinu, związku używanego w leczeniu niektórych chorób ucha. Był również stosowany, bez znaczących sukcesów, do łagodzenia skutków użądleń mrówek ognistych..
-Roztwory siarczanu glinu stosuje się w stężeniu od 5% do 10% w miejscowym leczeniu owrzodzeń, które pozwalają kontrolować ich wydzielanie.
-Ściągające działanie siarczanu glinu obkurcza powierzchowne warstwy skóry, powodując koagulację białek i gojenie się ran.
Inne zastosowania
-Siarczan glinu pomaga kontrolować nadmierny wzrost glonów w stawach, jeziorach i strumieniach. Wykorzystywany jest również do eliminacji mięczaków, m.in. ślimaka hiszpańskiego.
-Ogrodnicy stosują ten związek do zakwaszania gleb zasadowych. W kontakcie z wodą siarczan glinu rozkłada się na wodorotlenek glinu i rozcieńczony kwas siarkowy. Następnie wytrąca się wodorotlenek glinu, pozostawiając w roztworze kwas siarkowy..
-Zakwaszenie gleb przez kwas siarkowy jest wizualizowane w bardzo kreatywny sposób, dzięki istnieniu rośliny zwanej Hortensją, której kwiaty stają się niebieskie w obecności kwaśnej gleby; to znaczy są wrażliwe i reagują na zmiany pH.
-Siarczan glinu bierze udział w produkcji piany do gaszenia i gaszenia pożarów. W jaki sposób? Reaguje z wodorowęglanem sodu, powodując wydzielanie COdwa. Ten gaz blokuje dostęp Odwa do miejsca spalania materiału; a co za tym idzie zawieszenie broni, które się rozwijało.
Produkcja siarczanu glinu
Siarczan glinu jest syntetyzowany w reakcji związku bogatego w glin, takiego jak boksyt mineralny, z kwasem siarkowym w podwyższonej temperaturze. Następujące równanie chemiczne przedstawia reakcję:
DodwaLUB3 + H.dwapołudniowy zachód4 -> Aldwa(POŁUDNIOWY ZACHÓD4)3 + 3 HdwaLUB
Siarczan glinu można również wytworzyć w wyniku reakcji neutralizacji między wodorotlenkiem glinu a kwasem siarkowym, zgodnie z następującą reakcją:
2 Al (OH)3 + 3 Hdwapołudniowy zachód4 + 12 godzdwaO -> Aldwa(POŁUDNIOWY ZACHÓD4)3.18HdwaLUB
Kwas siarkowy reaguje z glinem, tworząc siarczan amonu i uwalniając cząsteczki wodoru w postaci gazu. Reakcja jest opisana w następujący sposób:
2 Al + 3 Hdwapołudniowy zachód4 -> Aldwa(POŁUDNIOWY ZACHÓD4)3 + 3 Hdwa
Rodzaje
Siarczan glinu dzieli się na dwa typy: typ A i typ B. W siarczanie glinu typu A ciało stałe jest koloru białego i ma stężenie żelaza poniżej 0,5%.
W siarczanie glinu typu B ciało stałe jest koloru brązowego i ma stężenie żelaza poniżej 1,5%.
Istnieją branże produkujące siarczan glinu, które mają różne kryteria klasyfikacji. W związku z tym przemysł zgłasza przy wytwarzaniu siarczanu glinu typu A o maksymalnym stężeniu 0,1% żelaza w postaci tlenku żelaza. Podczas gdy dla typu B wskazują maksymalne stężenie żelaza 0,35%.
Toksyczność
-Siarczan glinu jest związkiem, który poprzez kontakt z pyłem wywiera toksyczne działanie, powodując podrażnienia skóry, aw przypadku częstego kontaktu - zapalenia skóry..
-W oczach powoduje silne podrażnienia, powodując nawet trwałe obrażenia.
-Wdychanie powoduje podrażnienie nosa i gardła, co może powodować kaszel i szorstkość.
-Spożycie powoduje podrażnienie żołądka, nudności i wymioty.
-Istnieją efekty toksyczne, które nie są bezpośrednio spowodowane siarczanem glinu, ale są pośrednio spowodowane jego użyciem. Tak jest w przypadku niektórych toksycznych skutków glinu, spowodowanych użyciem siarczanu glinu do oczyszczania wody..
-Pacjenci przewlekle dializowani solami przygotowanymi w wodzie oczyszczonej, przy użyciu siarczanu glinu, doświadczają bardzo poważnych zaburzeń zdrowotnych. Wśród tych zaburzeń mamy anemię, otępienie dializacyjne oraz nasilenie chorób kości.
Bibliografia
- Wikipedia. (2018). Siarczan glinu. Zaczerpnięte z: en.wikipedia.org
- Aris Industrial. Roztwór siarczanu glinu typu A i B. Pobrano z: aris.com.pe
- Christophera Boyda. (9 czerwca 2014). Najważniejsze zastosowania przemysłowe siarczanu glinu. Zaczerpnięte z: chemservice.com
- PubChem. (2018). Bezwodny siarczan glinu. Zaczerpnięte z: pubchem.ncbi.nlm.nih.gov
- Andesia Chemicals. (20 sierpnia 2009). Arkusz bezpieczeństwa siarczanu glinu. [PDF]. Zaczerpnięte z: andesia.com
- Książka chemiczna. (2017). Siarczan glinu. Zaczerpnięte z: chemicalbook.com



Jeszcze bez komentarzy