
Trzecia zasada formuł termodynamiki, równania, przykłady
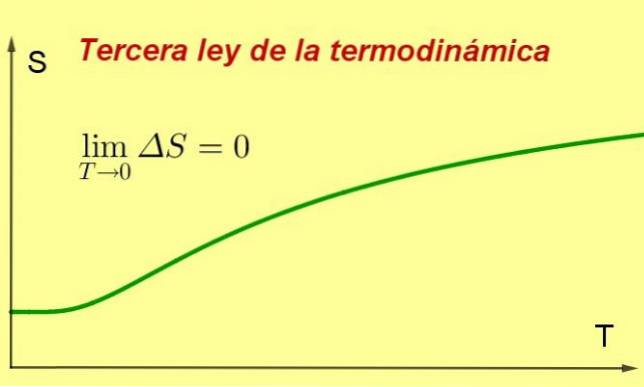
Plik Trzecia zasada termodynamiki stwierdza, że entropia zamkniętego układu termodynamicznego w równowadze ma tendencję do bycia minimalną i stałą, gdy jego temperatura zbliża się do 0 kelwinów.
Ta wartość entropii będzie niezależna od zmiennych systemowych (między innymi ciśnienia lub przyłożonego pola magnetycznego). Dzieje się tak, że gdy temperatura zbliża się do 0 K, procesy w systemie zatrzymują się, a ponieważ entropia jest miarą wewnętrznego pobudzenia, z konieczności spada..
Indeks artykułów
- 1 Poprzednie koncepcje
- 1.1 Układ termodynamiczny
- 1.2 Systemy izolowane, zamknięte lub otwarte
- 1.3 Makrostaty i mikropaństwa
- 2 Wzory i równania
- 2.1 Obliczanie bezwzględnej entropii substancji
- 3 Aplikacje
- 3.1 Entropia systemu w niskiej temperaturze
- 3.2 Szczątkowa entropia
- 4 Przykłady
- 4.1 Przykład 1: zero absolutne i nieokreśloność Heisenberga
- 4.2 Przykład 2: Nadciekłość i dziwny przypadek helu-4
- 5 Ćwiczenia rozwiązane
- 5.1 - Ćwiczenie 1
- 5.2 - Ćwiczenie 2
- 6 Odnośniki
Poprzednie koncepcje
Aby zrozumieć zakres trzeciej zasady termodynamiki, mającej znaczenie w bardzo niskich temperaturach, należy zapoznać się z następującymi pojęciami:
Układ termodynamiczny
Ogólnie odnosi się do gazu, cieczy lub ciała stałego. To, co nie jest częścią systemu, nazywa się środowisko. Najpowszechniejszym układem termodynamicznym jest gaz idealny, który składa się z cząstek N (atomów), które oddziałują tylko poprzez zderzenia sprężyste.
Systemy izolowane, zamknięte lub otwarte
Systemy izolowane nie mogą wymieniać się z otoczeniem. Zamknięte systemy nie wymieniają materii z otoczeniem, ale wymieniają ciepło. Wreszcie, systemy otwarte mogą wymieniać zarówno materię, jak i ciepło z otoczeniem..
Makrostaty i mikropaństwa
Makrostat układu to zbiór wartości, które mają jego zmienne: ciśnienie, temperatura, objętość, liczba moli, entropia i energia wewnętrzna. Z drugiej strony, mikrostan - w przypadku gazu doskonałego - jest określony przez położenie i pęd każdej z cząstek N, które go tworzą, w danej chwili.
Wiele mikropaństw może skutkować tym samym makrostatem. W gazie w temperaturze pokojowej liczba możliwych mikrostanów jest ogromna, ponieważ liczba cząstek, które go tworzą, różne pozycje i różne energie, które mogą przyjąć, są bardzo duże..
Wzory i równania
Jak powiedzieliśmy, entropia jest termodynamiczną zmienną makroskopową, która mierzy stopień zaburzeń molekularnych układu. Stopień nieładu systemu jest tym większy, im większa jest liczba możliwych mikropaństw.
Pojęcie to jest potrzebne do sformułowania trzeciej zasady termodynamiki w formie matematycznej. Niech S będzie entropią układu, a zatem:

Entropia jest makroskopową zmienną stanu, która jest bezpośrednio związana z liczbą możliwych mikrostanów układu, za pomocą następującego wzoru:
S = k ln (W)
W powyższym równaniu: S reprezentuje entropię, W liczba możliwych mikropaństw systemu i k jest stałą Boltzmanna (k = 1,38 x 10-2. 3 J / K). Oznacza to, że entropia systemu jest k razy logarytm naturalny liczby możliwych mikropaństw.
Obliczanie bezwzględnej entropii substancji
Możliwe jest zdefiniowanie absolutnej entropii czystej substancji wychodząc z definicji zmienności entropii:

δQ = n. dop .dT
Tutaj cp jest molowym ciepłem właściwym an liczbą moli. Zależność molowego ciepła właściwego od temperatury jest danymi uzyskanymi doświadczalnie i znanymi dla wielu czystych substancji..
Zgodnie z trzecią ustawą o substancjach czystych:


Aplikacje
W życiu codziennym trzecia zasada termodynamiki ma niewiele zastosowań, w przeciwieństwie do pierwszej i drugiej zasady. Dzieje się tak, ponieważ jest to zasada odnosząca się do tego, co dzieje się w systemie, gdy zbliża się on do absolutnego 0, rzadkiego zakresu temperatur.
W rzeczywistości osiągnięcie absolutnych 0 lub −273,15 ° C jest niemożliwe (patrz przykład 1 poniżej) Jednak trzecie prawo ma zastosowanie podczas badania reakcji materiałów w bardzo niskich temperaturach.
Dzięki temu w fizyce materii skondensowanej pojawiły się ważne postępy, takie jak:
-Nadciekłość (patrz przykład 2 poniżej)
-Nadprzewodnictwo
-Techniki chłodzenia laserowego
-Kondensat Bosego-Einsteina
-Gazy nadciekłe Fermiego.

W skrajnie niskich temperaturach spadek entropii pozwala na pojawienie się interesujących zjawisk kwantowych. Dlatego zobaczmy, co dzieje się z entropią układu w bardzo niskiej temperaturze.
Entropia układu w niskiej temperaturze
Kiedy masz doskonałą krystaliczną substancję, jej minimalna entropia wynosi dokładnie zero, ponieważ jest to wysoce uporządkowany układ. W temperaturach bliskich zeru absolutnego materia znajduje się w stanie skondensowanym (ciekłym lub stałym), a wibracje kryształu są minimalne.
Niektórzy autorzy rozważają alternatywne stwierdzenie trzeciej zasady termodynamiki:
„Jeśli materia skrapla się, tworząc doskonały kryształ, kiedy temperatura zmierza do zera absolutnego, entropia dąży dokładnie do zera”.
Wyjaśnijmy niektóre aspekty poprzedniego stwierdzenia:
- Doskonały kryształ to taki, w którym każda cząsteczka jest identyczna iw którym struktura molekularna powtarza się identycznie w całości..
- Gdy temperatura zbliża się do zera absolutnego, drgania atomowe zmniejszają się prawie całkowicie.
Następnie kryształ tworzy pojedynczą konfigurację lub możliwy mikrostan, to znaczy W = 1, i dlatego entropia jest równa zeru:
S = k ln (1) = 0
Ale nie zawsze materiał schłodzony w pobliżu zera absolutnego tworzy kryształ, a tym bardziej kryształ ten jest doskonały. Dzieje się tak tylko wtedy, gdy proces chłodzenia jest bardzo powolny i odwracalny..
W przeciwnym razie czynniki, takie jak zanieczyszczenia obecne w szkle, umożliwiłyby istnienie innych mikropaństw. Dlatego W> 1, a entropia byłaby większa niż 0.
Szczątkowa entropia
Jeśli proces chłodzenia jest nagły, w jego trakcie system przechodzi przez kolejne stany nierównowagi, które prowadzą do zeszklenia materiału. W tym przypadku nie powstaje uporządkowana struktura krystaliczna, ale bezpostaciowe ciało stałe, którego struktura jest podobna do cieczy..
W takim przypadku minimalna wartość entropii w pobliżu zera absolutnego nie wynosi zero, ponieważ liczba mikropaństw jest znacznie większa niż 1. Różnica między tą entropią a zerową entropią doskonałego stanu krystalicznego jest znana jako resztkowa entropia.
Wyjaśnienie jest takie, że poniżej pewnej temperatury progowej system nie ma innego wyjścia, jak tylko zajmować mikrostany mniejszą energią, które, ponieważ są kwantowane, stanowią stałą liczbę.
Zadbają o utrzymanie stałej entropii, nawet gdy temperatura będzie nadal spadać do zera absolutnego..
Przykłady
Przykład 1: zero absolutne i nieokreśloność Heisenberga
Zasada nieokreśloności Heisenberga ustanawia, że niepewność położenia i pędu cząstki, na przykład atomów w sieci krystalicznej, nie są od siebie niezależne, ale raczej następują po następującej nierówności:
Δx ⋅ Δp ≥ h
Gdzie h jest stałą Plancka. Oznacza to, że niepewność położenia pomnożona przez niepewność pędu (masa razy prędkość) jest większa lub równa stałej Plancka, której wartość jest bardzo mała, ale nie wynosi zero: h = 6,63 x 10-3. 4 J s.
A co ma wspólnego zasada nieoznaczoności z trzecią zasadą termodynamiki? Jeśli położenie atomów w sieci krystalicznej jest stałe i precyzyjne (Δx = 0), wówczas prędkość tych atomów może przyjąć dowolną wartość od 0 do nieskończoności. Zaprzecza temu fakt, że w punkcie zera absolutnego ustaje wszelki ruch mieszania termicznego..
I odwrotnie, jeśli założymy, że w temperaturze zera absolutnego całe mieszanie ustaje, a pęd każdego atomu w sieci wynosi dokładnie zero (Δp = 0), wówczas zasada nieoznaczoności Heisenberga oznaczałaby, że nieokreśloność w pozycjach każdego atomu byłaby nieskończona, to znaczy mogą znajdować się w dowolnej pozycji.
W konsekwencji poprzedniego stwierdzenia liczba mikropaństw dążyłaby do nieskończoności, a entropia również miałaby nieokreśloną wartość.
Przykład 2: Nadciekłość i dziwny przypadek helu-4
W nadciekłości, która występuje w bardzo niskich temperaturach, materia traci tarcie wewnętrzne między swoimi cząsteczkami, tzw lepkość. W takim przypadku płyn mógłby krążyć bez tarcia w nieskończoność, ale problem polega na tym, że w tych temperaturach prawie nic nie jest cieczą poza helem..
Hel i hel 4 (jego najliczniejszy izotop) stanowią wyjątkowy przypadek, ponieważ przy ciśnieniu atmosferycznym i temperaturach bliskich zeru absolutnemu hel pozostaje w stanie ciekłym.
Gdy hel-4 zostanie poddany działaniu temperatury poniżej 2,2 K pod ciśnieniem atmosferycznym, staje się a nadciekły. To odkrycie miało miejsce w 1911 roku w Leyden przez holenderskiego fizyka Heike Kamerlingh Onnes (1853-1926).
Atom helu-4 to bozon. Bozony, w przeciwieństwie do fermionów, to cząstki, które mogą zajmować ten sam stan kwantowy. Dlatego bozony nie spełniają zasady wykluczenia Pauliego.
Wtedy wszystkie atomy helu-4 w temperaturach poniżej 2,2 K zajmują ten sam stan kwantowy i dlatego istnieje tylko jeden możliwy mikrostan, co oznacza, że nadciekły hel-4 ma S = 0.
Rozwiązane ćwiczenia
- Ćwiczenie 1
Rozważmy prosty przypadek, który składa się z układu złożonego tylko z trzech cząstek o trzech poziomach energii. W przypadku tego prostego systemu:
a) Określić liczbę możliwych mikropaństw dla trzech zakresów temperatur:
-wysoki
-Pół
-Krótki
b) Wyznacz za pomocą równania Boltzmanna entropię w różnych zakresach temperatur.
c) Omów wyniki i wyjaśnij, czy są one sprzeczne z trzecią zasadą termodynamiki..
Rozwiązanie
W skali molekularnej i atomowej energie, które system może przyjąć, są kwantowane, co oznacza, że mogą przyjmować tylko pewne dyskretne wartości. Ponadto, gdy temperatury są tak niskie, cząsteczki tworzące system mają tylko możliwość zajmowania najniższych poziomów energii..
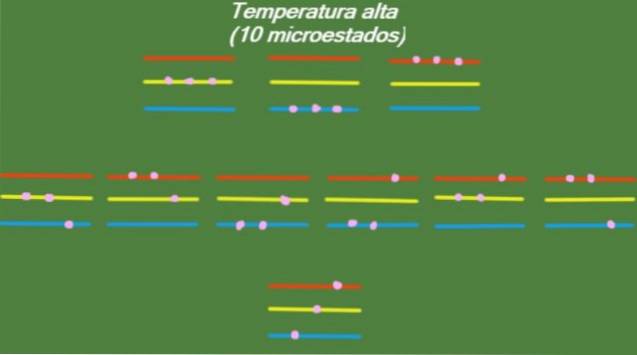
Wysoka temperatura
Jeśli system ma stosunkowo wysoką temperaturę T, wówczas cząstki mają wystarczającą energię, aby zająć wszelkie dostępne poziomy, co daje początek 10 możliwych mikrostanów, które pojawiają się na poniższym rysunku:
Średnia temperatura
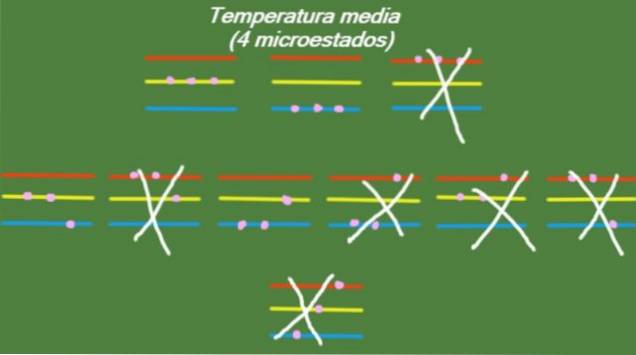
W przypadku, gdy układ ma temperaturę pośrednią, cząstki, które go tworzą, nie mają wystarczającej energii, aby zająć najwyższy poziom energii. Możliwe mikrostany przedstawiono na rysunku:
Niska temperatura
Jeśli temperatura w naszym wyidealizowanym układzie trzech cząstek i trzech poziomach energii będzie nadal spadać, wówczas cząstki będą miały tak mało energii, że będą w stanie zajmować tylko najniższy poziom. W takim przypadku pozostaje tylko 1 możliwy mikropaństwo, jak pokazano na rysunku 6:
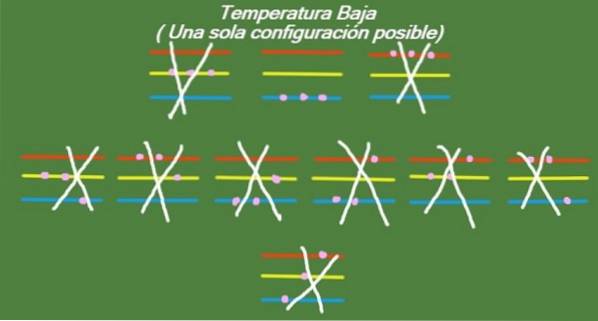
Rozwiązanie b
Gdy znana jest liczba mikrostanów w każdym zakresie temperatur, możemy teraz użyć podanego powyżej równania Boltzmanna, aby znaleźć entropię w każdym przypadku.
S = k ln (10) = 2,30 x k = 3,18 x 10-2. 3 J / K (Wysoka temperatura)
S = k ln (4) = 1,38 x k = 1,92 x 10-2. 3 J / K (Średnia temperatura)
I w końcu:
S = k ln (1) = 0 (Niska temperatura)
Rozwiązanie c
Najpierw zauważamy, że entropia maleje wraz ze spadkiem temperatury, zgodnie z oczekiwaniami. Ale dla najniższych wartości temperatury osiąga się wartość progową, od której osiągany jest stan podstawowy systemu..
Nawet gdy temperatura jest jak najbliższa zera absolutnego, nie ma dostępnych stanów o niższej energii. Wtedy entropia zachowuje stałą wartość minimalną, która w naszym przykładzie wynosi S = 0.
Ćwiczenie to ilustruje, na poziomie mikrostanu układu, powód, dla którego obowiązuje trzecia zasada termodynamiki..
- Ćwiczenie 2
Przyczyna, jeśli poniższe stwierdzenie jest prawdziwe lub fałszywe:
„Entropia systemu w temperaturze zera absolutnego wynosi dokładnie zero”.
Uzasadnij swoją odpowiedź i opisz kilka przykładów.
Rozwiązanie
Odpowiedź brzmi: fałsz.
Po pierwsze, absolutne 0 temperatury nie może zostać osiągnięte, ponieważ naruszyłoby to zasadę nieoznaczoności Heisenberga i trzecią zasadę termodynamiki..
Bardzo ważne jest, aby zauważyć, że trzecie prawo nie mówi, co dzieje się w absolutnym 0, ale raczej, gdy temperatura jest nieskończenie bliska absolutnemu 0. Różnica jest subtelna, ale znacząca.
Trzecie prawo nie stwierdza również, że kiedy temperatura przyjmuje wartość arbitralnie bliską zeru absolutnemu, entropia dąży do zera. Miałoby to miejsce tylko w przypadku wcześniej analizowanego: kryształu doskonałego, który jest idealizacją.
Wiele systemów w skali mikroskopowej, to znaczy w skali kwantowej, ma swój podstawowy poziom energii zdegenerowany, co oznacza istnienie różnych ustawień na najniższym poziomie energii.
Oznacza to, że w tych systemach entropia nigdy nie byłaby dokładnie zerowa. Również entropia nie byłaby dokładnie równa zeru w układach, które zeszklają, gdy temperatura dąży do zera absolutnego. W tym przypadku resztkowa entropia wcześniej widziałem.
Wynika to z faktu, że jego cząsteczki „utknęły” przed osiągnięciem najniższego dostępnego poziomu energii, co znacznie zwiększa liczbę możliwych mikropaństw, uniemożliwiając dokładne zerowanie entropii..
Bibliografia
- Cengel, rok 2012. Termodynamika. 7th Edition. McGraw Hill. 347.
- Laboratorium Napędów Odrzutowych. Najfajniejsze miejsce we Wszechświecie. Pobrane z: coldatomlab.jpl.nasa.gov.
- González, A. Entropia i spontaniczność. Odzyskany z: geocities.ws
- Quora. Jakie jest praktyczne zastosowanie trzeciej zasady termodynamiki? Odzyskany z: quora.com
- Chemia ogólna. Trzecia zasada termodynamiki. Odzyskany z: corinto.pucp.edu.pe
- Trzecia zasada termodynamiki. Odzyskany z: youtube.com
- Wikipedia. Szczątkowa entropia. Odzyskany z: en.wikipedia.com
- Wikipedia. Trzecia zasada termodynamiki. Odzyskany z: en.wikipedia.com



Jeszcze bez komentarzy