
Rodzaje wiązań chemicznych

Wiązania chemiczne to siły, które trzymają razem atomy tworząc cząsteczki. Istnieją trzy rodzaje wiązań między atomami:
- Wiązanie metaliczne.
- Wiązanie jonowe.
- Wiązanie kowalencyjne: niepolarne, polarne, pojedyncze, podwójne, potrójne, celownik.
Dzięki tym wiązaniom powstają wszystkie związki, które istnieją w przyrodzie. Istnieją również siły, które trzymają cząsteczki razem, znane jako wiązania międzycząsteczkowe, takie jak:
- Wiązania lub wiązania wodorowe.
- Siły dipolowo-dipolowe.
Następnie wyjaśniamy każdy z tych linków.
| Rodzaje wiązań chemicznych | Charakterystyka | Przykłady | |
|---|---|---|---|
| Metal | Jony metali unoszą się w morzu poruszających się elektronów. | Elementy metaliczne: sód, bar, srebro, żelazo, miedź. | |
| joński | Przeniesienie elektronów z jednego atomu na drugi. | Chlorek sodu Na+Cl- | |
| Kowalencyjne | Niepolarny | Podziel elektrony równo między dwoma atomami. | Wodór cząsteczkowy H-H lub H.dwa |
| Polarny | Nierównomierne dzielenie elektronów między dwoma atomami. | Cząsteczka wody H.dwaLUB | |
| Prosty | Udostępnij parę elektronów. | Cząsteczka chloru Cldwa Cl-Cl | |
| Podwójnie | Podziel dwie pary elektronów. | Cząsteczka tlenu Odwa O = O | |
| Potroić | Podziel trzy pary elektronów. | Cząsteczka azotu N≣N lub Ndwa | |
| Celownik | Tylko jeden z atomów dzieli elektrony. | Wiązanie azotu i boru w związku trifluorku amoniaku i boru. | |
| Siły międzycząsteczkowe | Most wodorowy | Wodory jednej cząsteczki są przyciągane do elektroujemnych atomów innej cząsteczki. | Wiązania wodoru między wodorem jednej cząsteczki wody a tlenem innej cząsteczki wody. |
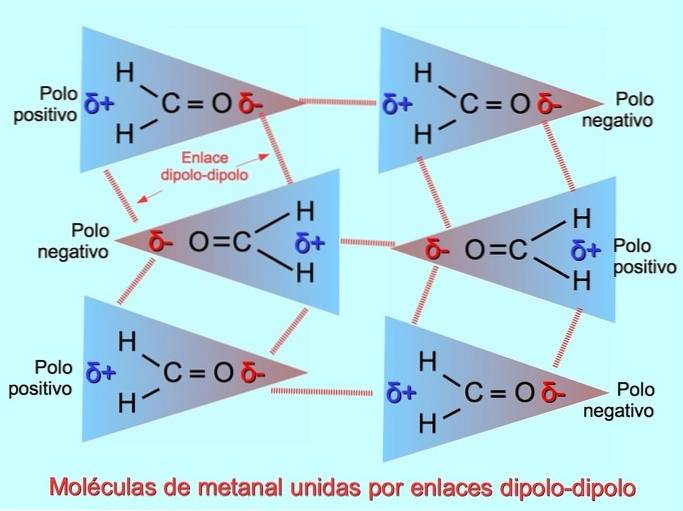
| Dipol-dipol | Cząsteczki z dwoma biegunami elektrycznymi przyciągają przeciwne bieguny innych cząsteczek. | Interakcje między cząsteczkami metanalu H.dwaC = O | |
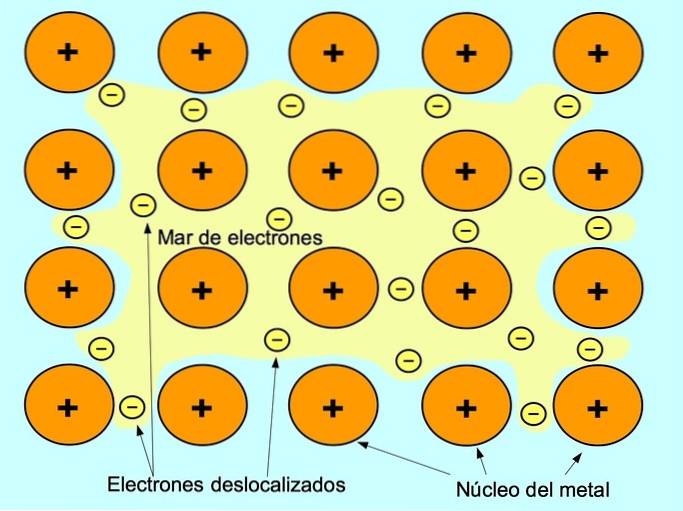
Wiązanie metaliczne
Wiązanie metaliczne to siła przyciągania między dodatnimi jonami pierwiastków metalicznych a ujemnymi elektronami, które swobodnie poruszają się między jonami. Atomy metali są ciasno upakowane, co pozwala elektronom poruszać się w sieci atomów.
W metalach elektrony walencyjne są uwalniane z ich pierwotnego atomu i tworzą „morze” elektronów, które unoszą się wokół całej struktury metalu. Powoduje to, że atomy metalu przekształcają się w dodatnio naładowane jony metali, które się zbierają..
Wiązanie metaliczne tworzy się między pierwiastkami metalicznymi, takimi jak sód Na, bar Ba, wapń Ca, magnez Mg, złoto Au, srebro Ag i aluminium Al.
Wiązanie jonowe
Wiązanie jonowe to siła, która łączy pierwiastek metaliczny, taki jak sód lub magnez, z pierwiastkiem niemetalicznym, takim jak chlor lub siarka. Metal traci elektrony i przekształca się w dodatni jon metalu zwany kation. Te elektrony przechodzą do niemetalicznego pierwiastka i przekształca się w ujemnie naładowany jon tzw anion.
Kationy i aniony łączą się i tworzą trójwymiarową sieć utrzymywaną przez siły przyciągania elektrostatycznego między jonami o różnych ładunkach. Siły te tworzą związki jonowe.
Skorupa ziemska składa się głównie ze związków jonowych. Większość skał, minerałów i kamieni szlachetnych to związki jonowe. Na przykład:
- Chlorek sodu NaCl: pierwiastkiem metalicznym jest sód, który przenosi elektron do chloru, który jest pierwiastkiem niemetalicznym.
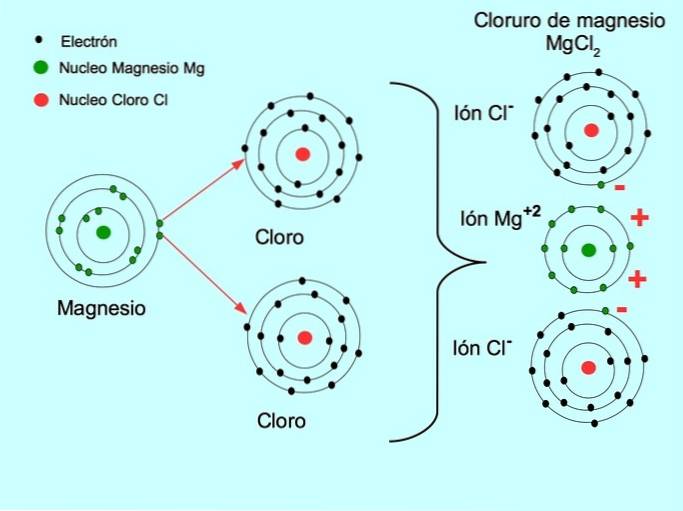
- Chlorek magnezu MgCldwa: Magnez Mg przekazuje dwa elektrony do dwóch atomów chloru, jak pokazano na poniższym rysunku:
Zobacz także Różnica między kationami i anionami.
Wiązanie kowalencyjne
Wiązanie kowalencyjne tworzy się, gdy dwa niemetaliczne atomy mają wspólne elektrony. Wiązanie to może mieć kilka typów w zależności od powinowactwa do elektronów atomów i liczby wspólnych elektronów.
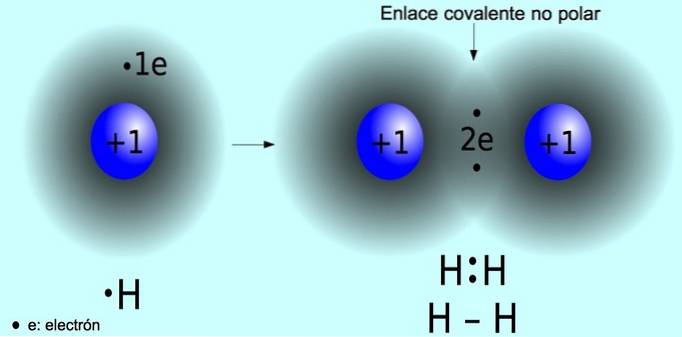
Niepolarne wiązanie kowalencyjne
Niepolarne wiązanie kowalencyjne to wiązanie, które tworzy się między dwoma atomami, w których elektrony są równo podzielone. To wiązanie zwykle występuje w cząsteczkach symetrycznych, to znaczy cząsteczkach złożonych z dwóch równych atomów, takich jak cząsteczka wodoru Hdwa i cząsteczkę tlenu Odwa.
Wiązanie kowalencyjne biegunowe
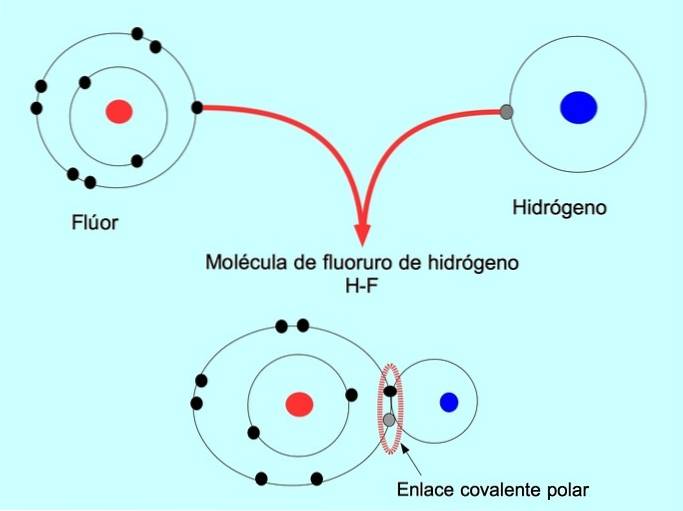
Polarne wiązanie kowalencyjne powstaje, gdy dwa atomy mają wspólne elektrony, ale jeden z nich jest bardziej przyciągany przez elektrony. To sprawia, że cząsteczka ma bardziej ujemny „biegun” z większą liczbą elektronów, a biegun przeciwny jest bardziej dodatni..
Cząsteczki o takim rozkładzie lub braku równowagi elektronów są znane jako polarne. Na przykład we fluorowodorze HF istnieje wiązanie kowalencyjne między wodorem i fluorem, ale fluor ma wyższą elektroujemność, więc silniej przyciąga wspólne elektrony..
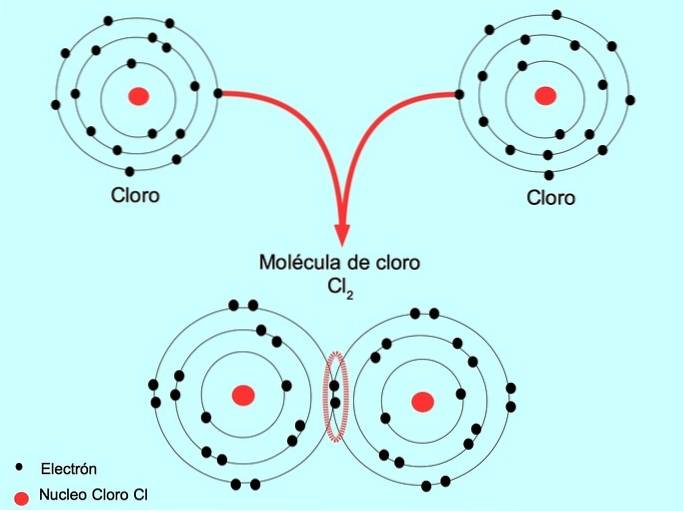
Proste wiązanie kowalencyjne
Kiedy dwa atomy mają wspólne dwa elektrony, po jednym z każdego, utworzone wiązanie kowalencyjne nazywa się prostym wiązaniem kowalencyjnym.
Na przykład chlor jest atomem, który ma siedem elektronów walencyjnych w swojej zewnętrznej powłoce, która może być wypełniona ośmioma elektronami. Chlor może łączyć się z innym chlorem, tworząc cząsteczkę chloru Cldwa który jest znacznie bardziej stabilny niż same chlorki.
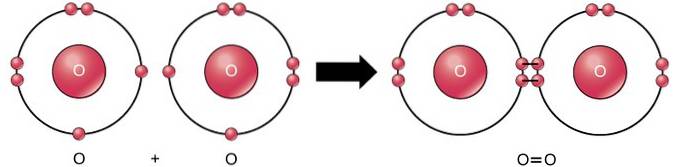
Podwójne wiązanie kowalencyjne
Podwójne wiązanie kowalencyjne to wiązanie, w którym cztery elektrony (dwie pary) elektronów znajdują się między dwoma atomami. Na przykład tlen ma 6 elektronów w swojej ostatniej powłoce. Kiedy łączą się dwa tlenki, cztery elektrony są dzielone między nimi, co powoduje, że każdy ma 8 elektronów w ostatniej powłoce..
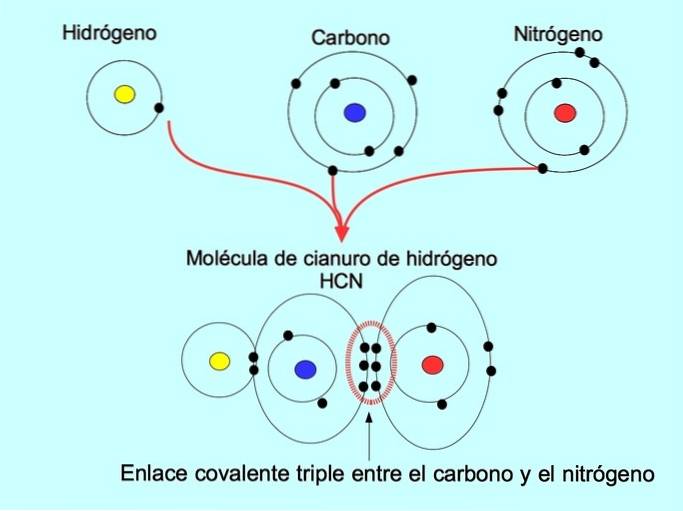
Potrójne wiązanie kowalencyjne
Potrójne wiązanie kowalencyjne powstaje, gdy 6 elektronów (lub trzy pary) jest podzielonych między dwa atomy. Na przykład w cząsteczce cyjanowodoru HCN powstaje potrójne wiązanie między węglem a azotem, jak pokazano na poniższym rysunku:
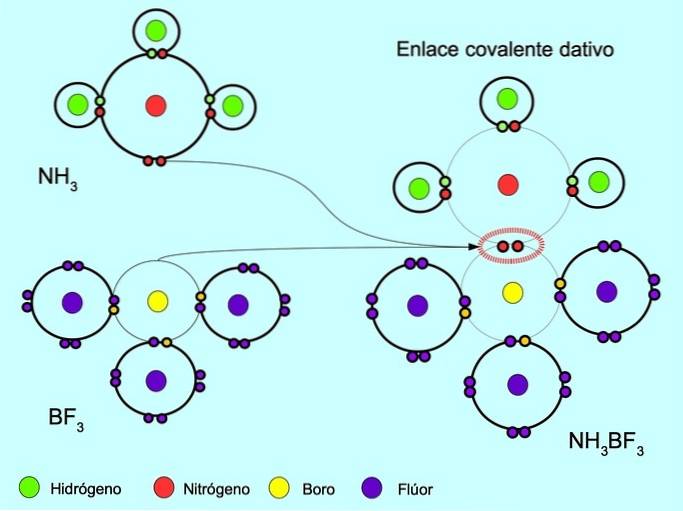
Kowalencyjne wiązanie współrzędnościowe lub celowe
Skoordynowane lub celowe wiązanie kowalencyjne to wiązanie, które tworzy się, gdy tylko jeden z atomów w wiązaniu dostarcza parę elektronów. Na przykład, gdy reaguje amoniak NH3 z trifluorkiem boru BF3, Azot wiąże się z dwoma elektronami bezpośrednio z borem, w którym nie ma dostępnych elektronów. W ten sposób zarówno azot, jak i bor pozostają z 8 elektronami w powłoce walencyjnej..
Zobacz także związki organiczne i nieorganiczne.
Powiązania międzycząsteczkowe
Cząsteczki łączą się za pomocą sił, które umożliwiają tworzenie substancji w stanie ciekłym lub stałym.
Wiązania lub siły dipolowo-dipolowe
Słabe wiązania międzycząsteczkowe można ustanowić między cząsteczkami polarnymi, gdy bieguny ujemne są przyciągane do biegunów dodatnich i odwrotnie. Na przykład metanal H.dwaC = O jest cząsteczką polarną, z częściowym ładunkiem ujemnym tlenu i dodatnim ładunkiem wodoru. Pozytywna strona jednej cząsteczki metanalu przyciąga ujemną stronę innej cząsteczki metanalu.
Wiązania lub wiązania wodorowe
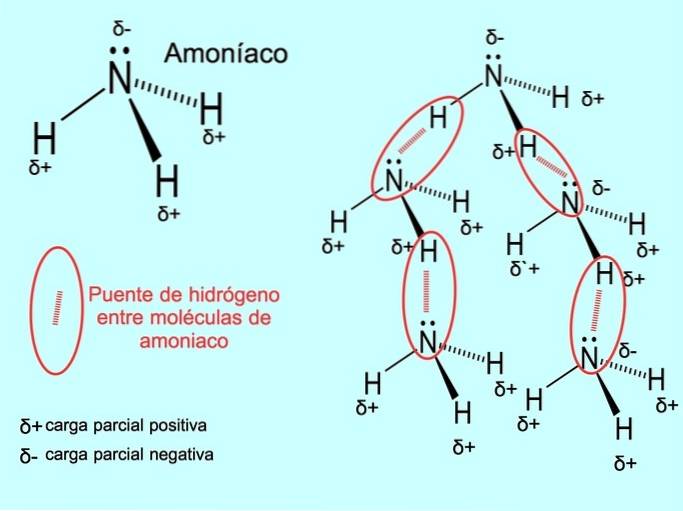
Wiązanie wodorowe lub wiązanie wodorowe to wiązanie, które tworzy się między cząsteczkami. Występuje, gdy wodór w cząsteczce jest kowalencyjnie związany z tlenem, azotem lub fluorem. Tlen, azot i fluor to atomy o większej elektroujemności, dlatego silniej przyciągają elektrony, gdy dzielą je z innym mniej elektroujemnym atomem..
Między cząsteczkami wody H występują wiązania wodorowedwaAmoniak O i NH3 jak na rysunku:
Możesz być zainteresowany zobaczeniem:
- Atomy i cząsteczki.
- Przykłady związków organicznych i nieorganicznych.
Bibliografia
Zumdahl, S.S., Zumdahl, S.A. (2014) Chemia. Dziewiąte wydanie. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. Wydanie 5. Pearson Australia. Melbourne.



Jeszcze bez komentarzy