
Struktura, właściwości i zastosowanie trójtlenku arsenu (As2O3)
Plik trójtlenek arsenu jest związkiem nieorganicznym, którego wzór chemiczny to AsdwaLUB3. Arsen w swoim metalicznym stanie szybko przekształca się w ten tlenek, który jest bardzo toksyczną trucizną, która może mieć ostre i przewlekłe objawy..
Ponieważ arsen i tlen są pierwiastkami bloku p, przy stosunkowo małej różnicy elektroujemności, oczekuje się, że AsdwaLUB3 ma charakter kowalencyjny; to znaczy, że wiązania As-O dominują w jego ciele stałym, nad oddziaływaniami elektrostatycznymi między jonami As3+ mniedwa-.

Ostre zatrucie trójtlenkiem arsenu następuje przy połknięciu lub inhalacji, których najważniejszymi objawami są: ciężkie zaburzenia żołądkowo-jelitowe, skurcze, zapaść krążeniowa i obrzęk płuc..
Jednak pomimo swojej toksyczności był używany przemysłowo; na przykład przy konserwacji drewna, przy produkcji pigmentów, półprzewodników itp. Podobnie był dawniej stosowany w leczeniu wielu chorób.
Trójtlenek arsenu jest związkiem amfoterycznym, rozpuszczalnym w rozcieńczonych kwasach i zasadach, nierozpuszczalnym w rozpuszczalnikach organicznych i stosunkowo rozpuszczalnym w wodzie. Występuje jako bryła (górny obraz), z dwiema formami krystalicznymi: sześcienną i jednoskośną.
Indeks artykułów
- 1 Struktura trójtlenku arsenu
- 1.1 Claudetite
- 1.2 Ciecz i gaz
- 1.3 Arsenolit
- 2 Właściwości
- 2.1 Nazwy handlowe
- 2.2 Masa cząsteczkowa
- 2.3 Wygląd fizyczny
- 2.4 Zapach
- 2.5 Smak
- 2.6 Temperatura wrzenia
- 2.7 Temperatura topnienia
- 2.8 Temperatura zapłonu
- 2.9 Rozpuszczalność w wodzie
- 2.10 Rozpuszczalność
- 2.11 Gęstość
- 2.12 Prężność par
- 2.13 Rozkład
- 2.14 Korozyjność
- 2.15 Ciepło parowania
- 2.16 Stała dysocjacji (Ka)
- 2.17 Współczynnik załamania światła
- 3 Reaktywność
- 4 Nazewnictwo
- 5 zastosowań
- 5.1 Przemysłowe
- 5.2 Lekarze
- 6 Odnośniki
Struktura trójtlenku arsenu
Claudetita
W temperaturze pokojowej AsdwaLUB3 krystalizuje do dwóch jednoskośnych polimorfów, oba występujące w minerale klaudetycie. Mają jednostki trójkątne piramidy AsO3, które są połączone atomami tlenu, aby samodzielnie skompensować usterkę elektroniki urządzenia.
W polimorfie jednostki AsO3 są połączone, tworząc rzędy (claudetite I), aw drugim są połączone, jakby tkali sieć (claudetite II):
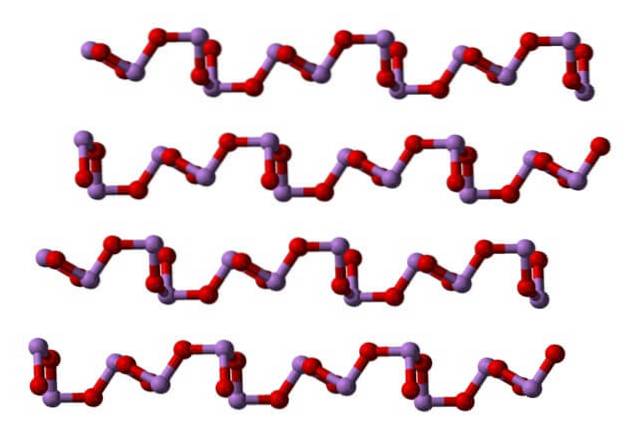
Płynne i gazowe
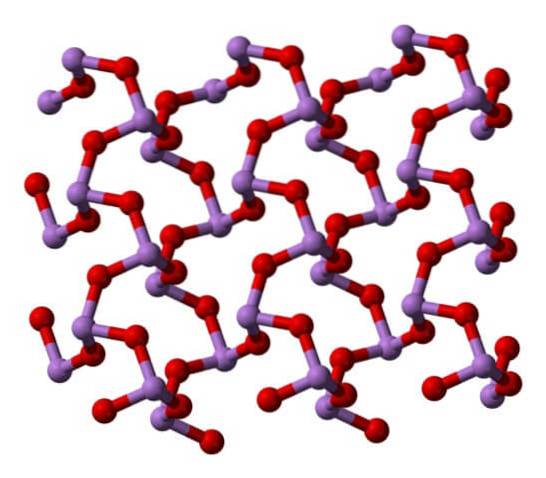
Kiedy wszystkie te struktury, które definiują kryształy jednoskośne, są ogrzewane, wibracje są takie, że kilka wiązań As-O zostaje zerwanych i ostatecznie przeważa mniejsza cząsteczka: As4LUB6. Jego strukturę przedstawia poniższy obrazek.

Można powiedzieć, że składa się z dimeru AsdwaLUB3. Jego stabilność jest taka, że utrzymuje 800 ° C w fazie gazowej; ale powyżej tej temperatury rozpada się na cząsteczki AsdwaLUB3.
Arsenolit
Ten sam as4LUB6 mogą ze sobą współdziałać, krystalizując się w sześcienną substancję stałą, której strukturę można znaleźć w mineralnym arsenolicie.
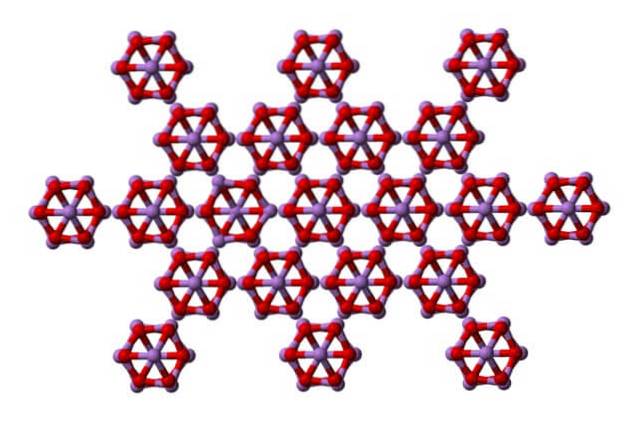
Zwróć uwagę, że obraz przedstawia strukturę z wyższej płaszczyzny. W porównaniu z klaudetytem, jego strukturalna różnica w stosunku do arsenolitu jest ewidentna. Tutaj są dyskretnymi cząsteczkami As4LUB6 że jednostki są utrzymywane przez siły Van der Waalsa.
Nieruchomości
Nazwy handlowe
-Arsenolit
-Arsodent
-Trisenox
-Claudetita
Waga molekularna
197,84 g / mol.
Wygląd fizyczny
-Białe kryształy sześcienne (arsenolit).
-Bezbarwne kryształy jednoskośne (Claudetite).
-Białe lub przezroczyste ciało stałe, szkliste, bezpostaciowe grudki lub krystaliczny proszek.
Zapach
Toaleta.
Smak
Bez smaku.
Temperatura wrzenia
460 ºC.
Temperatura topnienia
-313 ºC (Claudetite).
-274 ºC (arsenolit).
punkt zapłonu
485 º C (sublimuje).
Rozpuszczalność w wodzie
17 g / L przy 18 ºC (20 g / L przy 25 ºC).
Rozpuszczalność
Rozpuszczalny w kwasach (zwłaszcza kwasie solnym) i zasadach. Praktycznie nierozpuszczalny w chloroformie i eterze.
Gęstość
-3,85 g / cm3 (kryształki sześcienne);
-4,15 g / cm3 (kryształy rombowe).
Ciśnienie pary
2,47 10-4 mmHg przy 25 ºC.
Rozkład
Nie jest palny, ale po podgrzaniu może wydzielać toksyczny dym, który może zawierać arsyn..
Korozyjność
W obecności wilgoci może powodować korozję metali.
Ciepło parowania
77 kJ / mol.
Stała dysocjacji (Ka)
1,110-4 przy 25 ºC.
Współczynnik załamania światła
-1755 (Arsenolit)
-1,92-2,01 (Claudetite).
Reaktywność
-Trójtlenek arsenu jest związkiem amfoterycznym, ale działa przede wszystkim jako kwas.
-Może reagować z kwasem solnym lub fluorowodorowym, tworząc trichlorek arsenu lub trifluorek arsenu.
-Podobnie reaguje z silnymi utleniaczami, takimi jak kwas azotowy, powodując kwas arsenowy i podtlenek azotu..
-Trójtlenek arsenu może reagować z kwasem azotowym, wytwarzając arsynę lub pierwiastek arszenikowy, w zależności od warunków reakcji..
AsdwaLUB3 + 6 Zn + 12 HNO3 => 2 AsH3 + 6 Zn (NO3)dwa + 3 HdwaLUB.
Ta reakcja posłużyła jako podstawa do stworzenia testu Marsha, służącego do wykrywania zatrucia arszenikiem..
Nomenklatura
WdwaLUB3 Można go nazwać według następujących nomenklatur, wiedząc, że arsen działa z walencją +3:
-Tlenek arsenu (nomenklatura tradycyjna).
-Tlenek arsenu (III) (nomenklatura zapasów).
-Trójtlenek diarsenu (nomenklatura systematyczna).
Aplikacje
Przemysłowy
-Jest używany do produkcji szkła, w szczególności jako środek wybielający. Jest również używany do produkcji ceramiki, produktów elektronicznych i fajerwerków.
-Dodawany jest jako dodatkowy składnik do stopów na bazie miedzi w celu zwiększenia odporności stopów metali na korozję.
-AsdwaLUB3 jest materiałem wyjściowym do przygotowania arsenu pierwiastkowego, do ulepszania połączeń elektrycznych oraz do produkcji półprzewodników arsenkowych
-AsdwaLUB3, jak również arsenian miedzi, są używane jako środki konserwujące drewno. Został użyty w połączeniu z octanem miedzi do uzyskania zielonego pigmentu Paris, używanego do produkcji farb i rodentycydów..
Lekarze
-Trójtlenek arsenu to związek stosowany od wieków w leczeniu wielu chorób. Stosowano go jako tonik w leczeniu zaburzeń odżywiania, nerwobólów, reumatyzmu, artretyzmu, astmy, pląsawicy, malarii, kiły i gruźlicy.
-Stosowano go również w miejscowym leczeniu chorób skóry, niszcząc niektóre powierzchowne nabłonki..
-Roztwór Fowlera był stosowany w leczeniu chorób skóry i białaczki. Zaprzestano stosowania tego leku..
-XX wieku chiński badacz Zhang Tingdong prowadził badania nad zastosowaniem trójtlenku arsenu w leczeniu ostrej białaczki promielocytowej (APL). Co doprowadziło do produkcji leku Trisenox, który został zatwierdzony przez amerykańską FDA.
-Trisenox był stosowany u pacjentów z APL, którzy nie reagują na leczenie „pierwszego rzutu” składające się z kwasu all-trans retinowego (ATRA). Wykazano, że trójtlenek arsenu indukuje apoptozę komórek rakowych.
-Trisenox jest stosowany jako lek cytostatyczny w leczeniu opornego na leczenie podtypu promielocytów (M3) przez APL.
Bibliografia
- Shen i in. (2001). Badania skuteczności klinicznej i farmakokinetyki małych dawek trójtlenku arsenu w leczeniu nawrotowej ostrej białaczki promielocytowej: porównanie z dawką konwencjonalną. Leukemia 15, 735–741.
- Science Direct. (2014). Trójtlenek arsenu. Sevier. Odzyskany z: sciencedirect.com
- Wikipedia. (2019). Trójtlenek arsenu. Odzyskane z: en.wikipedia.org
- PubChem. (2019). Tlenek arsenu (III). Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Deborah M. Rusta i Steven L. Soignetb. (2001). Profil ryzyka / korzyści trójtlenku arsenu. The Onkologist vol. 6 Dodatek 2 29-32.
- New England Journal of Medicine. (11 lipca 2013). Kwas retinowy i trójtlenek arsenu w ostrej białaczce promielocytowej. n pol j med 369; 2.



Jeszcze bez komentarzy