
Właściwości, struktura, zastosowanie tlenku chloru (III)
Plik tlenek chloru (III) jest związkiem nieorganicznym, którego wzór chemiczny to CldwaLUB3. Odpowiada bezwodnikowi kwasu chlorawego, HClOdwa. Jest to ciemnobrązowe ciało stałe, silnie wybuchowe nawet w temperaturach poniżej 0ºC i słabo scharakteryzowane. Dlatego jest przedmiotem zainteresowania informatyki..
Chemicznie jest tlenkiem kowalencyjnym, więc są wiązania Cl-O i dyskretna cząsteczka CldwaLUB3 (dolny obraz). Taką cząsteczkę można z powodzeniem utworzyć przez odwodnienie HClOdwa, lub poddawanie go fotolizie w niskich temperaturach. Szczegół jest taki, że rozkłada się, tworząc Cldwa, LUBdwa, lub inne termodynamicznie stabilne tlenki chloru.
Ponieważ wiązania Cl-O są słabo polarne, cząsteczka CldwaLUB3 ma mały moment dipolowy; dlatego nie rozpuszcza się dobrze w wodzie ani nie oddziałuje z innymi polarnymi rozpuszczalnikami. Jego niestabilność jest taka, że nie jest znany do celów komercyjnych lub potencjalnych zastosowań (ani jego zastosowanie nie byłoby opłacalne jako materiał wybuchowy).
Głównym powodem jego niestabilności mogą być elektroniczne właściwości rzekomego Cl3+ (przy założeniu czysto jonowego charakteru). W rzeczywistości jego stopnie utlenienia +1 i +5 są najbardziej stabilne, gdy chlor tworzy związki z tlenem..
Indeks artykułów
- 1 Właściwości
- 2 Struktura tlenku chloru (III)
- 2.1 Izomery
- 3 Nazewnictwo
- 4 Zastosowania
- 5 Referencje
Nieruchomości
Ponieważ jego charakterystyka jest słaba i słabo udokumentowana, nie ma wiele do powiedzenia na temat jego właściwości, z wyjątkiem następujących punktów:
-Ma masę cząsteczkową 118,903.
-Jest to jednolity ciemny brąz; chociaż może sublimować gazowy chlor, wydzielając żółtawo-zielone opary.
-Brakuje mu zarówno punktu wrzenia, jak i temperatury topnienia, ponieważ w 0ºC wybucha (a także w niższych temperaturach).
-Jego rozpuszczalność w wodzie szacuje się na około 3,42 g / 100 ml, co dowodzi, że jest to cząsteczka kowalencyjna o niskiej polarności..
-Reaguje z wodą (małą ilością, która się rozpuszcza), aby przekształcić się w HClOdwa:
CldwaLUB3 + H.dwaLUB <=> 2HClOdwa
Struktura tlenku chloru (III)
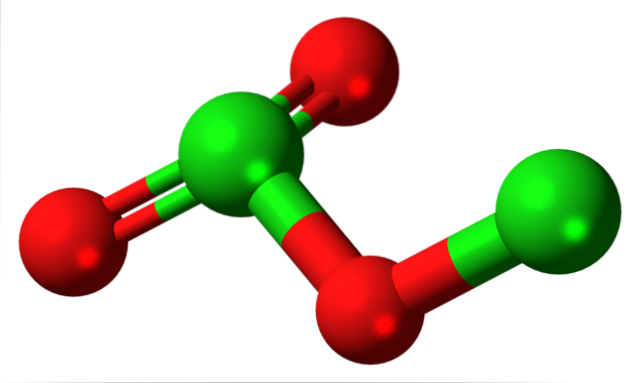
Zdjęcie pokazało strukturę molekularną CldwaLUB3 z modelem kul i prętów. Chociaż na pierwszy rzut oka może się tak nie wydawać, niewypowiedziane konsekwencje twoich linków i układów przestrzennych są bardziej skomplikowane, niż się wydaje. Ta struktura odpowiada jednemu z wielu możliwych izomerów tego związku..
Czerwone kule odpowiadają atomom tlenu, a zielone - atomom chloru. Chlor po lewej ma trójkątną geometrię piramidy z parą wolnych elektronów; można więc założyć, że ich hybrydyzacja musi być sp3. Atom tlenu działa jako pomost między dwoma chlorkami, Cl-O-Cl.
Izomery
Jakie są inne izomery? W teorii obliczanych jest dziewięć, z których cztery są najbardziej stabilne (w tym ten na obrazku). Pozostałe trzy miałyby struktury takie jak:
-ClClO3. Bardzo podobny do tego wyjaśnionego, ale z wiązaniem Cl-Cl.
-ClOOOCl (1). W tym izomerze znajduje się mostek trzech atomów tlenu, które oddzielają dwa atomy chloru (pamiętaj o geometrii kątowej HdwaLub wizualizować to).
-ClOOOCl (2). Ten sam utleniony mostek jest również obecny w tym izomerze, z wyjątkiem tego, że dwa atomy chloru są zaćmione w przestrzeni; jeden naprzeciw drugiego, podczas gdy w powyższym izomerze są odlegli.
Nomenklatura
Jego nazwa, tlenek chloru (III), odpowiada nazwie przypisanej zgodnie z nomenklaturą zapasów. Tutaj zakłada się, że chlor ma stopień utlenienia +3; ale to nie znaczy, że kation Cl3+ może być obecny. To cząsteczka, a nie sieć jonów.
Inna nazwa, pod którą znany jest również CldwaLUB3 oznacza trójtlenek dichloro, zgodnie z nomenklaturą systematyczną.
I wreszcie, nie tak powszechne (mimo że rządzi się tradycyjną nomenklaturą), istnieje nazwa bezwodnik chlorowy odnoszący się do tego związku. Ta nazwa wynika z faktu, że, jak już wyjaśniono, CldwaLUB3 występuje, gdy HClOdwa skrapla się uwalniając wodę.
Aplikacje
Ponieważ jest to tlenek chloru, jest to najbardziej bezpośrednie zastosowanie, jakie można sobie wyobrazić dla CldwaLUB3 Jest jak środek utleniający, zdolny do neutralizacji zanieczyszczeń organicznych i drobnoustrojów. Jest jednak bardzo niestabilny, a także wybuchowy, więc nie jest nawet uważany za przydatny do tego celu..
Na pewno nie ma informacji, jak zachowywałby się Cl.dwaLUB3 pod ogromnym ciśnieniem (jeśli nie wybuchnie w trakcie procesu). W normalnych warunkach wydaje się, że jest to nic innego jak stosunkowo stabilny i dający się rozróżnić związek pośredni między innymi bardziej stabilnymi tlenkami chloru..
Jednak pod względem obliczeniowym przedmiotem badań było określenie mechanizmów wolnych rodników, które obejmują różne rodzaje chloru i tlenu..
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Trójtlenek chloru. Odzyskane z: en.wikipedia.org
- Dale L. Perry. (2011). Podręcznik związków nieorganicznych. (Druga edycja). CRC Press Taylor & Francis Group.
- Richard C. Ropp. (2013). Encyklopedia związków ziem alkalicznych. Elsevier.
- Kim K. H., Han Y.K. i Lee Y. S. (1999). Podstawowy wpływ na stabilność izomerów Cl2O3 przy użyciu metod B3P86 i B3LYP teorii funkcjonału gęstości. Journal of Molecular Structure THEOCHEM 460 (1-3): 19–25.



Jeszcze bez komentarzy