
Struktura tlenku cyny (II), właściwości, nazewnictwo, zastosowania

Plik tlenek cyny (II) to krystaliczne nieorganiczne ciało stałe, które powstaje w wyniku utleniania cyny (Sn) przez tlen, w którym cyna uzyskuje wartościowość 2+. Jego wzór chemiczny to SnO. Znane są dwie różne formy tego związku: czarna i czerwona. Powszechną i najbardziej stabilną postacią w temperaturze pokojowej jest czarna lub niebieskawo-czarna odmiana..
Forma ta jest przygotowywana przez hydrolizę chlorku cyny (II) (SnCl)dwa) w roztworze wodnym, do którego dodaje się wodorotlenek amonu (NH4OH) w celu uzyskania osadu uwodnionego tlenku Sn (II) o wzorze SnO.xHdwaLub, gdzie x<1 (x menor que 1).
Uwodniony tlenek to biała bezpostaciowa substancja stała, którą następnie ogrzewa się w zawiesinie w temperaturze 60-70 ° C przez kilka godzin w obecności NH.4OH, aż do uzyskania czystego czarnego krystalicznego SnO.
Czerwona forma SnO jest metastabilna. Można go przygotować dodając kwas fosforowy (H.3PO4) - z 22% kwasem fosforowym, H.3PO3 - a potem NH4OH do roztworu SnCldwa. Otrzymaną białą substancję stałą ogrzewa się w tym samym roztworze w temperaturze 90-100 ° C przez około 10 minut. W ten sposób otrzymuje się czysty czerwony krystaliczny SnO.
Tlenek cyny (II) jest materiałem wyjściowym do produkcji innych związków cyny (II). Z tego powodu jest to jeden ze związków cyny o znaczącym znaczeniu handlowym..
Tlenek cyny (II) ma niską toksyczność, jak ma to miejsce w przypadku większości nieorganicznych związków cyny. Wynika to z jego słabego wchłaniania i szybkiego wydalania z tkanek żywych istot..
Ma jedną z najwyższych tolerancji związków cyny w testach na szczurach. Jednak może być szkodliwy w przypadku wdychania w dużych ilościach..
Indeks artykułów
- 1 Struktura
- 1.1 Niebiesko-czarny tlenek cyny (II)
- 1.2 Czerwony tlenek cyny (II)
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Gęstość
- 3.5 Rozpuszczalność
- 3.6 Inne właściwości
- 4 Zastosowania
- 4.1 Przy produkcji innych związków cyny (II)
- 4.2 W biżuterii
- 4.3 Inne zastosowania
- 4.4 Najnowsze innowacje
- 5 Referencje
Struktura
Niebiesko-czarny tlenek cyny (II)
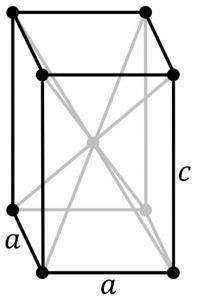
Ta modyfikacja krystalizuje z tetragonalną strukturą. Ma układ warstw, w którym każdy atom Sn znajduje się na szczycie kwadratowej piramidy, której podstawę tworzą 4 najbliższe atomy tlenu.
Inni badacze twierdzą, że każdy atom Sn jest otoczony przez 5 atomów tlenu, które znajdują się mniej więcej na wierzchołkach ośmiościanu, gdzie szósty wierzchołek jest przypuszczalnie zajęty przez parę wolnych lub niesparowanych elektronów. Jest to znane jako układ Φ-oktaedryczny.
Czerwony tlenek cyny (II)
Ta forma tlenku cyny (II) krystalizuje z rombową strukturą.
Nomenklatura
- Tlenek cyny (II)
- Tlenek cynawy
- Tlenek cyny
- Tlenek cynawy
Nieruchomości
Stan fizyczny
Krystaliczne ciało stałe.
Waga molekularna
134,71 g / mol.
Temperatura topnienia
1080 ºC. Rozkłada się.
Gęstość
6,45 g / cm3
Rozpuszczalność
Nierozpuszczalny w gorącej lub zimnej wodzie. Nierozpuszczalny w metanolu, ale szybko rozpuszcza się w stężonych kwasach i zasadach.
Inne właściwości
Po podgrzaniu do ponad 300 ° C w obecności powietrza, tlenek cyny (II) szybko utlenia się do tlenku cyny (IV), powodując żarzenie.
Doniesiono, że w warunkach nieutleniających ogrzewanie tlenku cyny (II) daje różne wyniki w zależności od stopnia czystości wyjściowego tlenku. Na ogół nieproporcjonalne do metalicznego Sn i tlenku cyny (IV), SnOdwa, z różnymi gatunkami pośrednimi, które ostatecznie stają się SnOdwa.
Tlenek cyny (II) jest amfoteryczny, ponieważ rozpuszcza się w kwasach dając jony Sndwa+ lub kompleksy anionowe, a także rozpuszcza się w alkaliach, tworząc roztwory jonów hydroksytinnianowych, Sn (OH)3-, które mają strukturę piramidalną.
Ponadto SnO jest środkiem redukującym i szybko reaguje z kwasami organicznymi i mineralnymi..
Ma niską toksyczność w porównaniu z innymi solami cyny. Jego LD50 (dawka śmiertelna 50% lub średnia dawka śmiertelna) u szczurów wynosi ponad 10 000 mg / kg. Oznacza to, że potrzeba więcej niż 10 gramów na kilogram, aby zabić 50% próbek szczurów w danym okresie testowym. Dla porównania, fluorek cynawy (II) ma LD50 wynoszącą 188 mg / kg u szczurów..
Jednak przy dłuższym wdychaniu odkłada się w płucach, ponieważ nie jest wchłaniany i może powodować stanozę (infiltrację pyłu SnO do szczelin płuc).
Aplikacje
W produkcji innych związków cyny (II)
Jego szybka reakcja z kwasami jest podstawą jego najważniejszego zastosowania, czyli półproduktu do produkcji innych związków cyny..
Wykorzystywany jest do produkcji bromku cyny (II) (SnBrdwa), cyjanek cyny (II) (Sn (CN)dwa) i hydrat fluoroboranu cyny (II) (Sn (BF4)dwa), wśród innych związków cyny (II).
Fluoroboran cyny (II) jest przygotowywany przez rozpuszczenie SnO w kwasie fluoroborowym i jest stosowany do powłok cynowych i cynowo-ołowiowych, zwłaszcza do osadzania stopów cynowo-ołowiowych do lutowania w przemyśle elektronicznym. Wynika to między innymi z jego dużej zdolności pokrycia.
Tlenek cyny (II) jest również używany do wytwarzania siarczanu cyny (II) (SnSO)4), w wyniku reakcji SnO i kwasu siarkowego, H.dwapołudniowy zachód4.
SnSO4 pozyskiwany jest stosowany w procesie cynowania do produkcji obwodów drukowanych, do wykańczania styków elektrycznych oraz do cynowania przyborów kuchennych.

Uwodniona postać SnO, uwodniony tlenek cyny (II) SnO.xHdwaLub jest traktowany kwasem fluorowodorowym w celu uzyskania fluorku cynawego (II), SnFdwa, który jest dodawany do past do zębów jako środek do walki z próchnicą.
W biżuterii
Tlenek cyny (II) jest używany do wytwarzania kryształów rubinowych złota z cyną i miedzi z cyną. Najwyraźniej jego funkcją w tym zastosowaniu jest działanie jako środek redukujący.

Inne zastosowania
Jest stosowany w urządzeniach fotowoltaicznych do produkcji energii elektrycznej ze światła, takich jak ogniwa słoneczne.

Najnowsze innowacje
Rozmieszczone nanocząsteczki SnO zostały wykorzystane w elektrodach węglowych nanorurek do akumulatorów litowo-siarkowych.

Elektrody przygotowane na SnO wykazują wysoką przewodność i niewielką zmianę objętości w powtarzalnych cyklach ładowania i rozładowania.
Ponadto SnO ułatwia szybkie przenoszenie jonów / elektronów podczas reakcji utleniania-redukcji, które występują w takich akumulatorach..
Bibliografia
- Cotton, F. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Bailar, J.C .; Emeléus, H.J.; Sir Ronald Nyholm i Trotman-Dickenson, A.F. (1973). Kompleksowa chemia nieorganiczna. Tom 2. Pergamon Press.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). Piąta edycja. Tom A27. VCH Verlagsgesellschaft mbH.
- Kirk-Othmer (1994). Encyklopedia technologii chemicznej. Tom 24. Wydanie czwarte. John Wiley & Sons.
- Ostrakhovitch, Elena A. i Cherian, M. George. (2007). Cyna. W Handbook of the Toxicology of Metals. Trzecia edycja. Odzyskany z sciencedirect.com.
- Kwestroo, W. i Vromans, P.H.G.M. (1967). Przygotowanie trzech modyfikacji czystego tlenku cyny (II). J. Inorg. Nucl. Chem., 1967, Vol. 29, str. 2187-2190.
- Fouad, S.S i in. (1992). Właściwości optyczne cienkich warstw tlenku cynawego. Czechosłowacki Journal of Physics. Luty 1992, tom 42, wydanie 2. Odzyskany ze strony springer.com.
- A-Young Kim i in. (2017). Zamówione nanocząsteczki SnO w MWCNT jako funkcjonalny materiał macierzysty dla wysokowydajnej katody baterii litowo-siarkowej. Nano Research 2017, 10 (6). Odzyskany z springer.com.
- National Library of Medicine. (2019). Tlenek cynawy. Odzyskany z: pubchem.ncbi.nlm.nih.gov

Jeszcze bez komentarzy